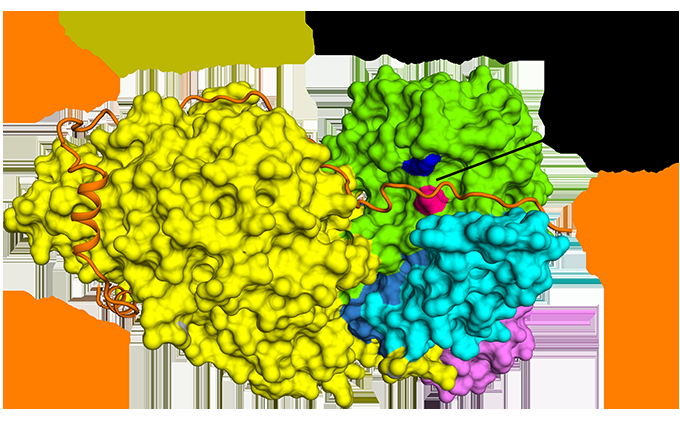
Figura 1:Il legame antiparallelo della securin rispetto alla separasi. Credito:sorgente luminosa a diamante
La struttura di un importante complesso proteico che regola la transizione metafase-anafase durante la progressione del ciclo cellulare è stata risolta utilizzando la microscopia crioelettronica (crio-EM) presso la Diamond Light Source. Lo studio strutturale, dettagliato in Biologia strutturale e molecolare della natura , ha fornito preziose informazioni sul funzionamento interno del complesso separasi-securin.
La separasi è un enzima responsabile della scissione delle subunità kleisin (Scc1 e Rec8) dell'anello di coesione che tiene insieme i cromatidi fratelli durante la mitosi. Una volta che i cromatidi sono liberati per separasi, segregano verso i poli opposti della cellula, pronti a formare nuovi nuclei in due cellule figlie identiche. La separasi è tenuta sotto controllo da un chaperone inibitorio noto come securin, che è anche curiosamente creduto di avere proprietà attivanti.
Sebbene scoperto quasi 20 anni fa, solo di recente è stata chiarita la struttura della separasi legata alla securin. Cryo-EM è stato intrapreso presso l'Electron Bio-Imaging Center (eBIC) di Diamond per determinare la struttura dell'intero complesso e per esplorare l'interazione molecolare tra separasi e securin. È stato scoperto che la securin forma una conformazione estesa per interagire lungo l'intera lunghezza di separase, e inibisce l'enzima attraverso un meccanismo pseudosubstrato nel sito attivo. Una piena comprensione di questa interazione e della natura del controllo del ciclo cellulare potrebbe aprire nuove strade per la progettazione di farmaci mirati.
Un complesso regolatore del ciclo cellulare
Quando i cromosomi vengono replicati, contengono ciascuno due cromatidi fratelli, e durante la divisione cellulare questi cromatidi devono separarsi in modo coordinato e accurato per produrre due nuclei figli identici. All'inizio della mitosi, i cromatidi fratelli sono tenuti insieme da un complesso proteico chiamato coesina; però, durante la transizione metafase-anafase la coesione viene scissa da un enzima proteasi noto come separasi per separare i cromatidi e consentire loro di spostarsi sui lati opposti della cellula appena prima che si divida.
La transizione dalla metafase all'anafase inizia quando una grande ubiquitina ligasi E3 multi-subunità, chiamato complesso promotore dell'anafase (o APC/C) segna un chaperone inibitorio, chiamato securin, con l'ubiquitina per la distruzione. Una volta che la securin è degradata, la separasi è libera di scindere la coesione e separare i cromatidi.
Il complesso separasi-securina è fondamentale per la divisione cellulare, eppure la struttura di questo duo non era stata risolta nella sua interezza. Dott. Andreas Boland, Postdoctoral Research Fellow nel gruppo del Dr David Barford presso il MRC Laboratory of Molecular Biology e co-responsabile dello studio, ha spiegato perché questo complesso è così affascinante:"La mis-segregazione del materiale genetico può portare ad aneuploidia e tumorigenesi, quindi questo è uno dei passaggi più importanti durante la progressione del ciclo cellulare. Paradossalmente, securin non solo previene la scissione prematura della coesione, ma può anche promuovere l'attività separase. Per comprendere in dettaglio i doppi meccanismi di attivazione e repressione abbiamo utilizzato la crio-EM a singola particella".
Struttura Cryo-EM con risoluzione 3.8-Å
Sono stati espressi complessi separasi-securin sia da C. elegans che dall'uomo, purificato, e applicato a griglie di carbonio d'oro ricoperte di ossido di grafene prima di essere congelato all'istante in etano liquido. Le micrografie Cryo-EM sono state raccolte utilizzando il microscopio Titan Krios presso eBIC con un ingrandimento calibrato di 47, 619, che corrispondeva a una dimensione in pixel di 1,05 Å.
Il dott. Boland ha notato il valore della crio-EM per questa applicazione:"I complessi proteici sono di dimensioni relativamente piccole, con meno di 250 kDa per l'uomo e solo circa 150 kDa per il complesso di C. elegans, ma contengono più domini e sono flessibili, quindi erano materiali difficili da cristallizzare. Cryo-EM è un'opzione fattibile anche per piccoli complessi proteici come questo".
Per la prima volta in assoluto, cryo-EM è stato utilizzato per determinare la struttura di risoluzione quasi atomica del complesso separasi-securin di C. elegans. Per di più, la struttura dell'equivalente umano del complesso è stata risolta ad una risoluzione media, rivelando la conservazione evolutiva della forma triangolare di separase.
Cryo-EM ha permesso al team di visualizzare come securin interagisce con separase. Adotta una conformazione antiparallela estesa per legarsi ai cerotti idrofobici lungo l'intera lunghezza della separasi. Curiosamente, queste interazioni idrofobiche hanno anche dimostrato di stabilizzare la separasi, potenzialmente spiegare gli effetti attivanti della securin sulla separasi. Inoltre, securin interagisce con il sito catalitico della separasi tramite un meccanismo pseudosubstrato. Un residuo di arginina presente nella posizione di scissione P1 nei substrati di coesione Scc1 e Rec8 è sostituito in securin da un residuo idrofobo. Questa sostituzione è responsabile della distorsione della geometria del sito catalitico separasi nella posizione di scissione del substrato, bloccando di conseguenza la sua attività proteasica.
La separasi è cruciale per la progressione del ciclo cellulare, quindi potrebbe essere un interessante target farmaceutico. mutazioni, sovraespressione, e l'errata localizzazione della separasi hanno dimostrato di essere associati allo sviluppo di tumori come il cancro al seno.
Il dottor Boland intende continuare a studiare il complesso:"In futuro, vogliamo migliorare la risoluzione del complesso umano separasi-securina per ottenere una risoluzione atomica o quasi atomica. Vorremmo anche capire come il complesso separasi-securin sia legato e ubiquitinato dall'APC/C per contrassegnarlo per la distruzione, quindi continueremo a utilizzare la crio-EM per questo scopo".