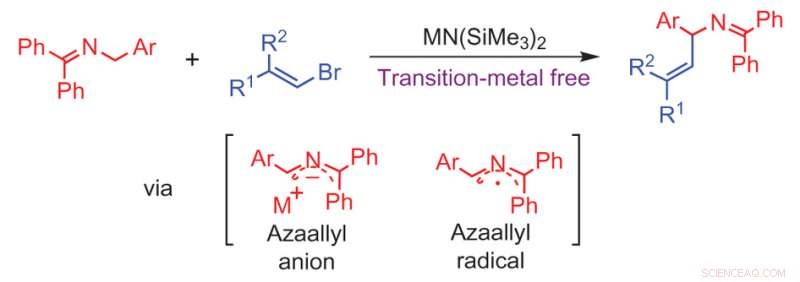
Vinificazione senza metalli di transizione di anioni azaallile. Credito:(c) Chimica della natura (2017). DOI:10.1038/nchem.2760
(Phys.org)—Alcuni gruppi funzionali tendono a presentarsi spesso nei prodotti naturali e nelle molecole biologicamente rilevanti. Tra questi gruppi funzionali ci sono le ammine alliliche. I protocolli tipici per la sintesi di ammine alliliche comportano una reazione di accoppiamento carbonio-carbonio che richiede un catalizzatore di metallo di transizione. Però, catalizzatori di metalli di transizione tendono ad essere costosi, in particolare se una reazione viene eseguita su scala commerciale. Per di più, le aziende sono interessate ad alternative verdi alla catalisi dei metalli di transizione.
I ricercatori dell'Università della Pennsylvania hanno sviluppato un meccanismo per produrre ammine alliliche senza l'uso di catalizzatori di metalli di transizione. Il loro lavoro è il primo caso segnalato di C(sp .) privo di metalli di transizione 3 )-C(sp 2 ) accoppiamento di elettrofili bromuro di vinile con anioni azaallile e radicali azaallile. Il loro lavoro appare in Chimica della natura .
"Questo lavoro apre diverse nuove strade che potrebbero influenzare molti tipi di trasformazioni, " dice la professoressa Marisa C. Kozlowski uno dei principali autori dello studio. "La formazione della specie radicale da parte di un carbanione che dona un elettrone mostra un ingresso non metallico a queste importanti specie reattive. Inoltre, questa chimica aggiunge un meccanismo distinto nell'accoppiamento incrociato che consente di generare determinate architetture in modo più efficiente".
Basandosi sul loro lavoro precedente per la produzione di ammine alliliche tramite un 1, Anione 1-difenil-3-arilallil-2-azaallile, Li et al. hanno scoperto che quando hanno reagito una chetimina con un bromuro di vinile per formare il loro anione azaallile, la successiva reazione di vinilazione è avvenuta senza la necessità di un catalizzatore al palladio. la sp 2 carbonio sull'alogenuro di vinile aggiunto alla sp 3 carbonio sull'anione aril azaallile (vedi figura). Questo tipo di reazione di accoppiamento carbonio-carbonio richiede tipicamente un catalizzatore di metallo di transizione.
Utilizzando una base stericamente impedita, [MN(SiMe 3 ) 2 dove M =Li, N / A], la reazione non deprotona il prodotto e dà come risultato una buona resa del prodotto di E-vinilazione. Questo meccanismo è regioselettivo, reagendo con il carbonio immina, e chemoselettivo per la formazione dell'ammina allilica sulla reazione concorrente che forma un alchino terminale dal bromuro di vinile.
Una volta Li et al. ottimizzato le loro condizioni di reazione, hanno testato la portata del loro nuovo meccanismo. Generalmente, il loro meccanismo ha successo con una serie di gruppi funzionali sulla N-benzilammina e sul bromuro di vinile. Gli autori riferiscono di aver dovuto regolare alcune delle condizioni di reazione a seconda dei gruppi funzionali sulla N-benzilammina, ma, globale, la reazione ha funzionato per gruppi elettron attrattori, come 4-alogenuri e 3, 5-di-CF 3 . Inoltre, questa reazione ha funzionato per i gruppi donatori di elettroni, come 4-metile e con composti eterociclici, come piridilchetimine e tiofenilchetimine.
Gli autori hanno quindi esaminato la versatilità del bromuro di vinile. La loro reazione ha tollerato un'ampia gamma di prodotti a base di bromuro di vinile, inclusi diversi bromuri di vinile arile e bromuro di vinile alifatico. È importante sottolineare che gli autori non hanno rilevato isomerizzazione e ciclizzazione con nessuno dei bromuri di vinile testati.
Sono stati condotti studi computazionali e sperimentali per comprendere meglio il meccanismo nella speranza di testare altri tipi di gruppi funzionali in futuro. Li et al. alla fine determinò un meccanismo che coinvolgeva un insolito radicale intermedio formato dal trasferimento di elettroni dell'anione azaallile dopo la deprotonazione della chetimina. Studi di risonanza paramagnetica elettronica hanno confermato che è coinvolta una specie radicale, ma sono necessari ulteriori studi per comprendere la natura di questa specie e se il/i radicale/i sia direttamente coinvolto nella reazione di vinilazione.
Gli autori ritengono che il radicale sia probabilmente un radicale azaallile e che sia l'anione azaallile che il radicale azaallile siano intermedi in un meccanismo che dipende dal substrato sul bromuro di vinile. Però, sarebbero necessari ulteriori studi per confermarlo.
Questa ricerca apre le porte alla produzione di prodotti naturali senza l'uso di un catalizzatore di metalli di transizione per una reazione che richiede tipicamente metalli di transizione. Ulteriori ricerche esamineranno la versatilità di questa reazione e la sua successiva applicazione.
© 2017 Phys.org