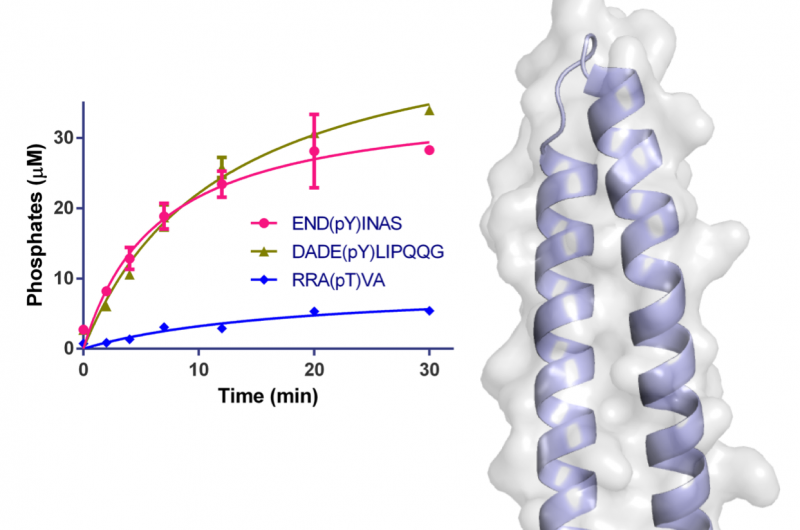
Figura 1:Struttura di WipA nella rappresentazione a fumetto e superficie semitrasparente. Il dominio della fosfatasi è rappresentato in rosso-verde e la bobina a spirale attaccata in azzurro. I residui coinvolti nella catalisi sono rappresentati come bastoncini attorno agli ioni Mn2+ e fosfato. La superficie è mostrata in grigio chiaro. Il grafico dell'inserto mostra la desfosforilazione nel tempo di specifici peptidi utilizzando 20 nM di WipA. Credito:sorgente luminosa a diamante
Scienziati londinesi hanno chiarito la struttura di un grande frammento di una proteina batterica, noto come WipA, secreto da Legionella pneumophila. Il lavoro, recentemente pubblicato in Journal of Biological Chemistry , hanno mostrato che la proteina possiede alcune caratteristiche affascinanti che hanno fornito preziose informazioni sul suo meccanismo d'azione.
Il batterio, L. pneumophila, provoca una grave forma di polmonite nota come malattia del legionario. La patogenicità di questo batterio dipende dalla secrezione di oltre 300 proteine effettrici nell'ospite. Un tale effettore, WipA, ha attirato l'attenzione per la sua dipendenza da un complesso chaperone (necessario per garantire la funzionalità delle proteine) per la sua secrezione e il suo ruolo sconosciuto nella patogenicità.
Due delle linee di luce di cristallografia macromolecolare (MX) (I02 e I04) a Diamond Light Source sono state utilizzate per avviare lo studio e risolvere la struttura cristallina di un grande frammento di WipA. La struttura ha mostrato che la proteina possedeva una piega serina/treonina fosfatasi che mirava sorprendentemente ai peptidi tirosina-fosforilati. Inoltre, è stato ipotizzato che WipA potesse passare da uno stato omo-dimerico a uno stato etero-dimerico per interagire con un bersaglio ospite tirosina-fosforilato. Le scoperte aiuteranno a chiarire i meccanismi molecolari alla base della patogenicità della Legionella e potrebbero favorire lo sviluppo di inibitori.
Vapore infetto
La malattia del legionario può essere letale tra i membri vulnerabili di una popolazione, ed è particolarmente pericoloso durante le epidemie ospedaliere. Una delle principali fonti di infezione da Legionella è il vapore acqueo negli impianti di condizionamento, caldaie, bagni e docce calde.
Una volta che un ospite respira il vapore infetto, i batteri entrano nei polmoni e cercano i globuli bianchi, noti come macrofagi. I batteri vengono inghiottiti dai macrofagi, ma invece di essere ucciso da loro, i batteri impiegano abilmente un sistema di secrezione di tipo IVb per secernere una vasta gamma di proteine effettrici nella cellula ospite al fine di dirottare il macchinario cellulare dell'ospite e garantire la sopravvivenza batterica.
Screening esteso
Il frammento principale di WipA è stato cristallizzato con successo rimuovendo entrambi i terminali della sequenza che prevedevano regioni non strutturate. I cristalli sono stati inizialmente analizzati alle linee di luce I02 e I04 di Diamond, mentre il lavoro è stato completato presso la linea di luce PetraIII P13 presso il Laboratorio europeo di biologia molecolare ad Amburgo.
A Diamante, la linea di luce Microfocus MX (I04) è stata utilizzata per lo screening dei cristalli e I02 per la raccolta dei dati di diffrazione. Il dottor Nikos Pinotsis è un ricercatore post-dottorato in biologia strutturale e molecolare nel laboratorio del professor Gabriel Waksman presso l'Istituto di biologia strutturale e molecolare di Birkbeck/UCL e co-investigatore dello studio. Ha spiegato il loro approccio, "Anche se la dimensione dei cristalli WipA era sufficiente per gli esperimenti di diffrazione su cristallo singolo, la maggior parte di essi mostrava reticoli multipli e/o disordinati, pertanto uno screening approfondito è stato fondamentale per acquisire con successo dati ad alta risoluzione e di qualità. Abbiamo ottimizzato le nostre strategie di raccolta dati su una dimensione del raggio che si adattasse sufficientemente alla più corta delle dimensioni del cristallo e ottimizzato il raggio massimizzando il raggio e il tempo di esposizione, riducendo al minimo i danni da radiazioni".
Primo della sua classe
La struttura del frammento WipA mostrava una piega della fosfatasi montata su una forcina elicoidale, che era il primo della sua classe. Il nucleo di questa struttura assomigliava a una proteina fosfatasi serina/treonina, ma gli esperimenti biochimici hanno mostrato inaspettatamente che aveva una preferenza per i substrati tirosina-fosforilati. Questa osservazione sorprendente era stata notata solo una volta prima tra diverse centinaia di fosfatasi simili.
Il dott. Pinotsis ha spiegato la rilevanza dei risultati:"Una volta noto il target dell'ospite per la defosforilazione da parte di WipA, gli inibitori potrebbero essere progettati per inibire tale interazione. Sebbene sia possibile che questi risultati possano portare alla progettazione di antibatterici, contribuiscono principalmente a una comprensione generale della sopravvivenza e della patogenicità di un batterio, che è un primo passo molto importante per stabilire trattamenti di lunga durata contro le infezioni".
Il team prevede di identificare il bersaglio WipA all'interno delle cellule ospiti e continuerà a esplorare ulteriori interazioni proteina-proteina per fornire una visione più completa del meccanismo di infezione della Legionella.