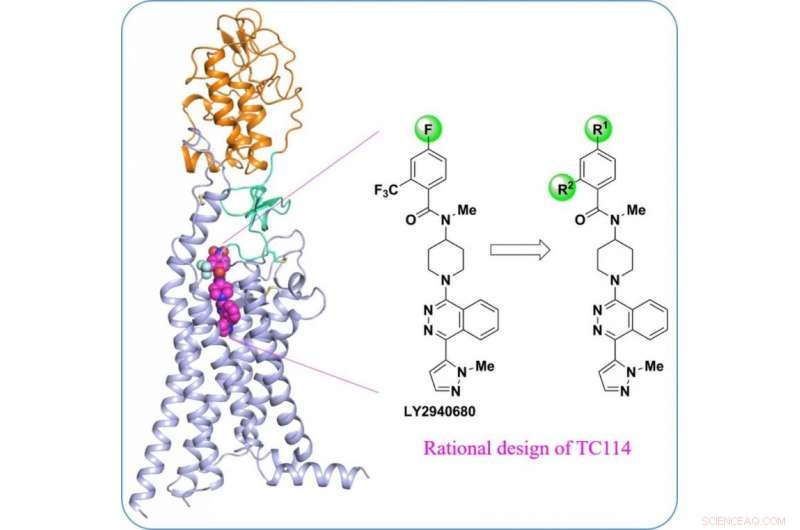
Struttura del recettore Smoothened umano multi-dominio, un importante bersaglio farmacologico per i tumori. Credito:ShanghaiTech University
Un team di scienziati guidato dall'iHuman Institute della ShanghaiTech University in collaborazione con la Fudan University ha determinato la struttura cristallina ad alta risoluzione del recettore levigato umano multidominio. I risultati illustrano le interazioni allosteriche dominio-dominio all'interno del recettore, e il loro ruolo nell'attivazione graduale. Questi nuovi risultati sono pubblicati il 17 maggio, 2017 in Comunicazioni sulla natura , intitolato "Struttura cristallina di un recettore levigato umano multidominio in complesso con un ligando super stabilizzante, " di Zhang X-J et al.
In qualità di attore centrale nella via di segnalazione di Hedgehog coinvolta nello sviluppo embrionale e nella tumorigenesi, il recettore levigato (SMO) è stato a lungo ricercato come bersaglio di farmaci per numerosi tumori. La resistenza ai farmaci, tuttavia, è stata un problema a causa delle mutazioni nell'SMO. "Lo sviluppo di farmaci anti-SMO di nuova generazione sarà facilitato dalla comprensione della disposizione multi-dominio nella struttura SMO", disse Fei Xu, Assistant Professor presso iHuman Institute, Università tecnologica di Shanghai, e l'autore corrispondente principale di questo articolo. "Questa struttura ci consentirà di identificare potenziali nuovi siti di legame del ligando e meccanismi di segnalazione".
"Per stabilizzare la proteina SMO umana multidominio, abbiamo progettato una serie di composti per strumenti chimici", disse Houchao Tao, Professore Associato di Ricerca presso iHuman Institute. "TC114 è una sonda che stabilizza in modo significativo e blocca il recettore in un'unica conformazione". Con un'ulteriore ottimizzazione, Il dottorando Xianjun Zhang ha risolto la struttura SMO multidominio legata a TC114 a 2,9 angstrom utilizzando un laser a elettroni liberi a raggi X. "Questa struttura rivela il dominio cerniera che può svolgere importanti ruoli modulatori nel connettere i domini, fornendo suggerimenti per lo sviluppo di nuovi modulatori mirati a questa regione", disse Xianjun Zhang.
"Questo è un bel lavoro di squadra", ha detto Raymond Stevens, Direttore dell'Istituto iHuman, Università tecnologica di Shanghai, "La chimica e la biologia sono unite in questa scienza per comprendere la struttura e la funzione di questo complesso recettore multidominio. La struttura cristallina, a sua volta, apre nuove strade per la scoperta di farmaci".