Credito:Katsutoshi Nagaoka
(Phys.org) — L'idrogeno ha il potenziale per fornire un'alternativa, fonte di energia pulita, in particolare per quanto riguarda la tecnologia delle celle a combustibile. Le attuali fonti di carburante coinvolgono combustibili fossili contenenti carbonio o molecole organiche contenenti carbonio, che determinano la produzione di CO . in eccesso 2 , un gas serra. Diverse iniziative, compresa un'iniziativa nazionale in Giappone, cercare di creare una società a basso utilizzo di carbonio utilizzando fonti di carburante alternative.
L'iniziativa Energy Carriers in Giappone è un progetto nazionale che sta studiando in modo specifico modi per immagazzinare e trasportare in modo efficiente l'idrogeno. Un modo per farlo è usare l'ammoniaca come fonte di idrogeno. Però, la scoperta di un processo efficiente per abbattere l'ammoniaca si è rivelata difficile, in gran parte perché il processo catalitico per abbattere l'ammoniaca richiede l'aggiunta continua di calore, che può essere proibitivo.
Katsutoshi Nagaoka, Takaaki Eboshi, Yuma Takeishi, Ryo Tasaki, Kyoto Honda, Kazuya Imamura, e Katsutoshi Sato dell'Università di Oita in Giappone hanno sviluppato un metodo che utilizza un nuovo catalizzatore per produrre idrogeno dall'ammoniaca senza l'aggiunta di calore esterno attraverso il ciclo catalitico. Il loro lavoro appare in Progressi scientifici .
La decomposizione dell'ammoniaca in idrogeno e azoto è un processo endotermico, il che significa che richiede l'aggiunta di energia per ottenere prodotti. Ciò significa che le tradizionali reazioni di decomposizione catalitica richiedono l'aggiunta di una grande quantità di calore per ottenere una quantità utile di gas idrogeno.
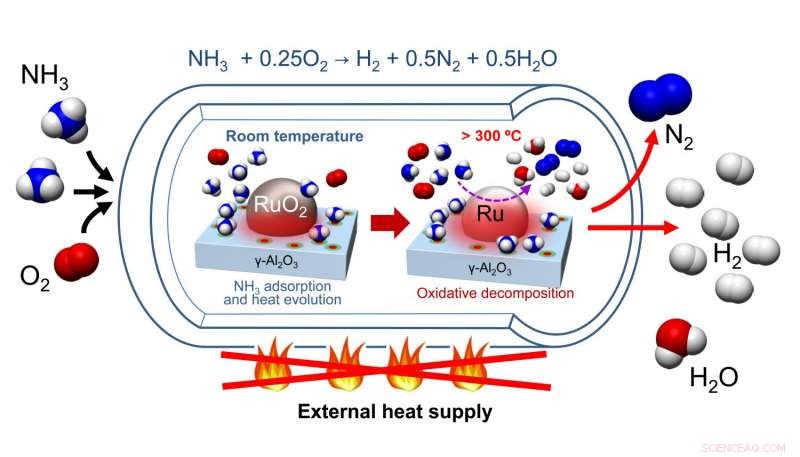
Nagaoka et al. ha sviluppato un catalizzatore costituito da un RuO 2 nanoparticelle supportate su γ-Al 2 oh 3 letto catalizzatore. Dopo aver spurgato il loro catalizzatore di H 2 O e CO 2 , ammoniaca e ossigeno sono stati aggiunti al recipiente di reazione dove l'ammoniaca è stata adsorbita sulla superficie catalitica, con conseguente aumento della temperatura. Questo aumento di temperatura ha catalizzato la decomposizione ossidativa dell'ammoniaca, un processo esotermico. Questo ha riscaldato la reazione, che a loro volta, forniva l'energia per la decomposizione endotermica dell'ammoniaca in idrogeno e azoto.
Il pretrattamento del catalizzatore ha richiesto il riscaldamento per rimuovere acqua e anidride carbonica, ma non ha richiesto il successivo riscaldamento. I test sul ciclo del catalizzatore hanno mostrato che dopo il pretrattamento iniziale del RuO 2 /γ-Al 2 oh 3 catalizzatore con elio a 300 o C, il catalizzatore è stato in grado di eseguire un ciclo tre volte e continuare a produrre idrogeno con le massime rese. Per di più, questi studi includevano la passivazione ossidativa per garantire che non fosse prodotto calore dall'ossidazione di Ru a RuO 2 . In pratica, non sarà necessaria la passivazione ossidativa. Così, anche se è necessario il riscaldamento per pretrattare il catalizzatore, il riscaldamento non è richiesto per cicli aggiuntivi del catalizzatore.
Nel tentativo di capire come il RuO 2 /γ-Al 2 oh 3 catalizzatore funziona, Nagaoka et al. confrontato la temperatura massima del letto catalitico che risulta dall'autoriscaldamento di RuO 2 / -Al 2 oh 3 a RuO 2 /La 2 oh 3 , un noto catalizzatore di decomposizione dell'ammoniaca. Hanno scoperto che il catalizzatore a base di alluminio si è riscaldato a una temperatura massima di 97 o C, mentre il catalizzatore a base di lantanio riscaldato ad una temperatura massima di 53 o C. Questo è importante perché la temperatura di autoaccensione per la combustione ossidativa dell'ammoniaca è di 90 o C, e spiega perché sono state osservate migliori rese di reazione con RuO 2 / -Al 2 oh 3 .
Gli autori sottolineano che questa differenza nella temperatura di adsorbimento è probabilmente dovuta alla favorevole interazione tra ammoniaca, una molecola di base, e Al 2 oh 3 , che è un acido di Lewis. La 2 oh 3 , d'altra parte, è una base di Lewis.
Inoltre, gli autori hanno esaminato la differenza tra l'utilizzo di -Al . nudo 2 oh 3 come catalizzatore e RuO 2 / -Al 2 oh 3 . Hanno scoperto che il 90% dell'ammoniaca si adsorbe sul -Al2O3 nudo rispetto al letto del catalizzatore e al RuO 2 nano particella. Ciò implica che l'ammoniaca viene chemisorbita sulla nanoparticella e -Al 2 oh 3 , che poi promuove il fisisorbimento multistrato.
Globale, questo tipo di catalizzatore è utile per fornire calore sufficiente per superare i requisiti di calore necessari per la decomposizione endotermica dell'ammoniaca in idrogeno e azoto gassoso. Questo studio mostra che la catalisi autoriscaldante è un'opzione praticabile per esplorare soluzioni alle difficoltà pratiche nell'uso dell'ammoniaca come fonte di idrogeno.
© 2017 Phys.org