Pinzatura peptidica. Credito:Università di Leeds
Scienziati britannici hanno creato un nuovo metodo per strutturare i peptidi, che dicono sarà più economico e renderà il processo di utilizzo dei peptidi graffati nella scoperta di farmaci molto più ampiamente disponibile.
Il metodo sviluppato dal team di nove membri dell'Università di Leeds, e sfruttando la chimica di sintesi sviluppata presso l'University College di Londra, è più versatile, più economico, completamente reversibile e si traduce in peptidi le cui proprietà farmacocinetiche, come la solubilità potrebbe essere facilmente regolata, secondo il professor Andrew Wilson, che ha condotto lo studio.
L'approccio potrebbe consentire a scienziati esperti di vincolare un peptide, consegnarlo a una cella particolare e poi liberarlo, impedendogli di uscire di nuovo dalla cellula.
Rendere i peptidi più utili
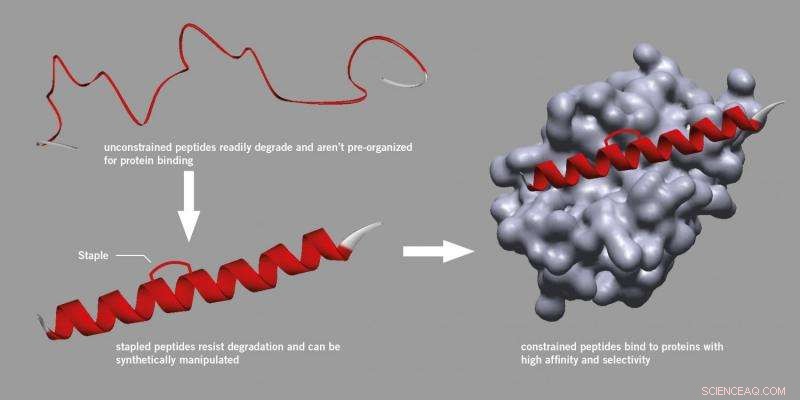
Scienziati e produttori di farmaci generalmente considerano i peptidi con scetticismo, credendo che siano troppo inaffidabili per essere usati come farmaci perché sono facilmente degradabili nelle cellule e sono difficili da manipolare.
Tuttavia, la ricerca iniziata all'Università di Harvard ha trovato un metodo per introdurre un tutore che potrebbe essere attaccato a un peptide, rafforzando la sua struttura attiva e rendendola più stabile e meno soggetta a degradazione.
Questo processo, noto come 'stapling' utilizza un metodo sintetico specifico ed è ora diventato un approccio riconosciuto nella scoperta di farmaci peptidici, anche con conseguente creazione di nuove società. I peptidi pinzati non si rompono, si legano meglio alle proteine e hanno proprietà farmacocinetiche migliorate come l'assorbimento cellulare.
Interazioni proteina-proteina
Un diffuso cambiamento di prospettiva sui peptidi è sorto a causa della necessità per l'industria farmaceutica di sviluppare farmaci che agiscano sulle interazioni proteina-proteina, in contrasto con la tradizionale modalità di riconoscimento "lock-and-key" sfruttata dalla maggior parte dei farmaci attuali. Piccole molecole che agiscono sulle interazioni proteina-proteina devono coprire una superficie più grande e meno convessa.
Professor Wilson, la cui squadra lavora su questo problema, ha dichiarato:"Gli scienziati hanno avuto un successo limitato nello sviluppo di piccole molecole tradizionali che agiscono sulle interazioni proteina-proteina, e lo sviluppo di peptidi in questo modo è un'alternativa interessante".
Ha aggiunto:"I livelli molto maggiori di contatto tra il peptide e la proteina possono essere sfruttati per ottenere una maggiore affinità e selettività, quindi siamo rimasti entusiasti di questo approccio alternativo alla pinzatura".
Aminoacidi naturali
Il team dell'Università di Leeds ha portato il principio della pinzatura peptidica a un nuovo livello. Il metodo si basa sulla reazione di due tioli in sequenza peptidica con un reagente dibromomaleimmide.
Quando i due tioli sono posizionati correttamente nella sequenza peptidica la reazione fa sì che la struttura resti bloccata in una forma elicoidale specifica e bioattiva più stabile.
Il metodo lavora su sequenze peptidiche contenenti gli amminoacidi naturali e comuni cisteina o omocisteina. Ciò consentirà l'accesso a peptidi adatti tramite metodi chimici e biologici di routine.
Professor Wilson, della School of Chemistry e dell'Astbury Center for Structural Molecular Biology dell'Università di Leeds ha dichiarato:"Il nostro approccio alla pinzatura proteica è più flessibile, potenzialmente più economico, e dovrebbe essere più facile da usare nella biologia chimica e nella scoperta di farmaci.
Il documento di ricerca completo Double Quick, Double Click Reversible Peptide 'Stapling' è pubblicato nella Royal Society of Chemistry's Scienze chimiche rivista il 31 maggio 2017.
Dottor Michael Webb, Professore Associato di Chimica Organica presso l'Università di Leeds, ha dichiarato:"Abbiamo sviluppato un nuovo metodo per introdurre rapidamente un vincolo funzionale in due peptidi modello che migliora una gamma di proprietà biofisiche e biochimiche. A differenza di altri metodi, può anche essere invertito.
"Questo approccio può essere effettuato utilizzando amminoacidi naturalmente disponibili, potenzialmente portando la pinzatura peptidica a una comunità più ampia.
"La capacità di invertire il vincolo può consentire la consegna di reagenti a base di peptidi nella cellula dove possono essere non vincolati ed essere meno facili da trasportare di nuovo".