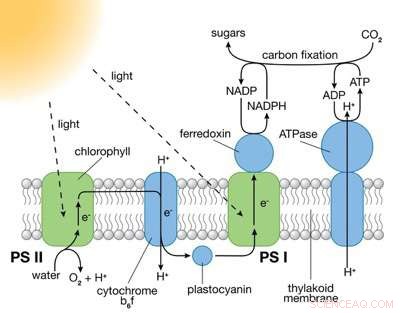
I fotosistemi (PS) I e II sono grandi complessi proteici che contengono molecole di pigmento che assorbono la luce necessarie per la fotosintesi. PS II cattura l'energia dalla luce solare per estrarre gli elettroni dalle molecole d'acqua, scindendo l'acqua in ossigeno e ioni idrogeno (H+) e producendo energia chimica sotto forma di ATP. PS I usa quegli elettroni e H+ per ridurre NADP+ (una molecola portatrice di elettroni) a NADPH. L'energia chimica contenuta in ATP e NADPH viene quindi utilizzata nella reazione della fotosintesi indipendente dalla luce per convertire l'anidride carbonica in zuccheri. Credito:Brookhaven National Laboratory
La fotosintesi nelle piante verdi converte l'energia solare in energia chimica immagazzinata trasformando l'anidride carbonica atmosferica e l'acqua in molecole di zucchero che alimentano la crescita delle piante. Gli scienziati hanno cercato di replicare artificialmente questo processo di conversione dell'energia, con l'obiettivo di produrre combustibili ecocompatibili e sostenibili, come idrogeno e metanolo. Ma imitando le funzioni chiave del centro fotosintetico, dove biomolecole specializzate svolgono la fotosintesi, si è rivelato impegnativo. La fotosintesi artificiale richiede la progettazione di un sistema molecolare in grado di assorbire la luce, trasporto e carica elettrica separata, e catalizzare le reazioni che producono carburante, tutti processi complicati che devono operare in sincronia per ottenere un'elevata efficienza di conversione dell'energia.
Ora, i chimici del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) e della Virginia Tech hanno progettato due fotocatalizzatori (materiali che accelerano le reazioni chimiche all'assorbimento della luce) che incorporano singoli componenti specializzati per l'assorbimento della luce, separazione di carica, o catalisi in una singola "supramolecola". In entrambi i sistemi molecolari, più centri di raccolta della luce fatti di ioni metallici rutenio (Ru) sono collegati a un singolo centro catalitico fatto di ioni metallici rodio (Rh) attraverso una molecola ponte che promuove il trasferimento di elettroni dai centri Ru al catalizzatore Rh, dove si produce l'idrogeno.
Hanno confrontato le prestazioni di produzione di idrogeno e analizzato le proprietà fisiche delle supramolecole, come descritto in un documento pubblicato nell'edizione online del 1 giugno di Giornale della Società Chimica Americana , per capire perché il fotocatalizzatore con sei assorbitori di luce anziché tre Ru produce più idrogeno e rimane stabile per un periodo di tempo più lungo.
"Sviluppare sistemi molecolari efficienti per la produzione di idrogeno è difficile perché i processi si verificano a velocità diverse, " ha detto l'autore principale Gerald Manbeck, un chimico nel gruppo di fotosintesi artificiale al Brookhaven Lab. "Completare il ricambio catalitico dell'idrogeno prima delle cariche separate - l'elettrone eccitato dalla luce caricato negativamente e il "buco" positivo lasciato dopo che la molecola eccitata assorbe l'energia luminosa - avere la possibilità di ricombinarsi e produrre calore in modo dispendioso è una delle sfide principali. "
Un'altra complicazione è che sono necessari due elettroni per produrre ciascuna molecola di idrogeno. Affinché la catalisi avvenga, il sistema deve essere in grado di trattenere il primo elettrone abbastanza a lungo da far apparire il secondo. "Costruendo supramolecole con più assorbitori di luce che possono funzionare indipendentemente, stiamo aumentando la probabilità di utilizzare ogni elettrone in modo produttivo e migliorando la capacità delle molecole di funzionare in condizioni di scarsa illuminazione, " disse Manbeck.
Manbeck ha iniziato a produrre le supramolecole al Virginia Tech nel 2012 con la compianta Karen Brewer, coautore e il suo consulente post-dottorato. Scoprì che il sistema a quattro metalli (tetrametallico) con tre centri di assorbimento della luce Ru e un centro catalitico Rh produceva solo 40 molecole di idrogeno per ogni molecola di catalizzatore e smetteva di funzionare dopo circa quattro ore. In confronto, il sistema a sette metalli (eptametallico) con sei centri Ru e un centro Rh era più di sette volte più efficiente, pedalare 300 volte per produrre idrogeno per 10 ore. Questa grande disparità di efficienza e stabilità era sconcertante perché le supramolecole contengono componenti molto simili.
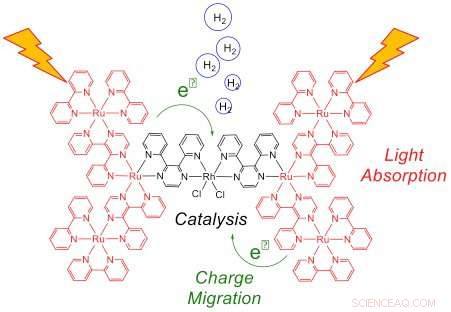
Questa rappresentazione del sistema eptametallico dopo l'esposizione alla luce mostra la raccolta della luce dai sei centri Ru (rosso) e il trasferimento di elettroni al catalizzatore Rh (nero), dove si produce l'idrogeno. Un efficiente trasferimento di elettroni a Rh è essenziale per ottenere elevate prestazioni catalitiche. Credito:Brookhaven National Laboratory
Manbeck è entrato a far parte di Brookhaven nel 2013 e da allora ha condotto una serie di esperimenti con il coautore Etsuko Fujita, leader del gruppo di fotosintesi artificiale, per comprendere le cause fondamentali della differenza di prestazioni.
"La capacità di formare lo stato di carica separata è un indicatore parziale del fatto che una supramolecola sarà un buon fotocatalizzatore, ma realizzare una separazione di carica efficiente richiede la messa a punto dell'energia di ciascun componente, " ha detto Fujita. "Per promuovere la catalisi, il catalizzatore Rh deve essere sufficientemente basso in energia per accettare gli elettroni dagli assorbitori di luce Ru quando gli assorbitori sono esposti alla luce."
Attraverso la voltammetria ciclica, una tecnica elettrochimica che mostra i livelli di energia all'interno di una molecola, gli scienziati hanno scoperto che il catalizzatore Rh del sistema eptametallico è leggermente più povero di elettroni e quindi più ricettivo alla ricezione di elettroni rispetto alla sua controparte nel sistema tetrametallico. Questo risultato suggeriva che il trasferimento di carica fosse favorevole nel sistema eptametallico ma non nel sistema tetrametallico.
Hanno verificato la loro ipotesi con una tecnica risolta nel tempo chiamata spettroscopia di assorbimento transitorio in nanosecondi, in cui una molecola viene promossa allo stato eccitato da un intenso impulso laser e viene misurato il decadimento dello stato eccitato nel tempo. Gli spettri risultanti hanno rivelato la presenza di un trasferimento di carica da Ru a Rh solo nel sistema eptametallico.
"I dati non solo hanno confermato la nostra ipotesi, ma hanno anche rivelato che la separazione della carica allo stato eccitato avviene molto più rapidamente di quanto avessimo immaginato, " disse Manbeck. "In effetti, la migrazione della carica avviene più velocemente della risoluzione temporale del nostro strumento, e probabilmente coinvolge di breve durata, stati eccitati ad alta energia." I ricercatori hanno in programma di cercare un collaboratore con una strumentazione più veloce in grado di misurare l'esatto tasso di separazione di carica per aiutare a chiarire il meccanismo.
In un esperimento successivo, gli scienziati hanno eseguito la misurazione dell'assorbimento transitorio in condizioni operative fotocatalitiche, with a reagent used as the ultimate source of electrons to produce hydrogen (a scalable artificial photosynthesis of hydrogen fuel from water would require replacing the reagent with electrons released during water oxidation). The excited state generated by the laser pulse rapidly accepted an electron from the reagent. They discovered that the added electron resides on Rh in the heptametallic system only, further supporting the charge migration to Rh predicted by cyclic voltammetry.
"The high photocatalytic turnover of the heptametallic system and the principles governing charge separation that were uncovered in this work encourage further studies using multiple light-harvesting units linked to single catalytic sites, " said Manbeck.