
Per la prima volta gli scienziati hanno catturato il macchinario cellulare che crea una molecola vitale nel processo di evoluzione. Un enzima chiave che le piante usano per produrre la tirosina, un amminoacido necessario per la vita, si pensava che fosse conservato in tutto il regno vegetale, ma gli scienziati hanno scoperto che è mutato in un'altra forma nei legumi. Nei pomodorini domina la forma canonica dell'enzima, le arachidi possono cambiare colpo e alcuni ceppi di soia (fagioli grumosi a destra) hanno perso la forma canonica. Credito:Jez Lab
Perché le piante non possono alzarsi e scappare, hanno dovuto essere intelligenti invece. Sono i chimici del mondo vivente, producendo centinaia di migliaia di piccole molecole che usano come filtri solari, per avvelenare i mangiatori di piante, per profumare l'aria, per colorare i fiori, e per molti altri affari vegetativi segreti.
Storicamente queste sostanze chimiche, chiamati "metaboliti secondari, " sono stati distinti da "metaboliti primari, " che sono i mattoni delle proteine, grassi, zuccheri e DNA. I metaboliti secondari facilitano la vita ma i metaboliti primari sono essenziali, e l'incapacità di realizzarli in modo corretto ed efficiente è fatale.
Si pensa che il metabolismo secondario si sia evoluto per aiutare gli antenati delle piante ad affrontare la vita sulla terraferma piuttosto che negli oceani più ospitali. L'idea è che i geni per gli enzimi nelle catene di montaggio molecolari del metabolismo primario siano stati duplicati. I duplicati erano più tolleranti nei confronti delle mutazioni che avrebbero potuto destabilizzare i percorsi primari perché gli originali erano ancora al lavoro. Con i vincoli evolutivi così allentati, macchinario sintetico è stato in grado di accumulare abbastanza mutazioni per fare nuova chimica.
Metabolismo primario, però, è ampiamente conservata, il che significa che rimane invariato in molti diversi gruppi di organismi perché è stato messo a punto per funzionare correttamente ed efficientemente e perché i suoi prodotti sono necessari per la vita. O così dicono i libri di testo.
Ma ora un team collaborativo di scienziati ha colto il metabolismo primario nell'atto di evolversi. In uno studio completo di una catena di montaggio del metabolismo primario negli impianti, hanno scoperto un enzima chiave che si evolve da una forma canonica posseduta dalla maggior parte delle piante, attraverso forme non canoniche nei pomodori, a una forma che colpisce l'interruttore trovata nelle noccioline, e infine impegnarsi nella nuova forma in alcuni ceppi di soia.
questa impresa, paragonabile a tirare fuori la tovaglia da sotto i piatti senza romperne nessuno, è descritto nel numero del 26 giugno di Natura chimica biologia . È il lavoro di una collaborazione tra il laboratorio Maeda dell'Università del Wisconsin, che ha un interesse di lunga data in questa via biochimica, e il laboratorio Jez alla Washington University di St. Louis, che ha cristallizzato l'enzima della soia per rivelare come la natura ha cambiato il modo in cui funziona la proteina.
"Il lavoro cattura le piante nel processo di costruzione di un percorso che collega il metabolismo primario a quello secondario, " disse Joseph Jez, l'Howard Hughes Medical Institute Professor presso il Dipartimento di Biologia in Arti e Scienze. "Stiamo finalmente vedendo come l'evoluzione crea i macchinari per creare nuove molecole".
Può anche avere un'importanza pratica perché la vecchia e la nuova via producono l'aminoacido tirosina, che è un precursore di molti metaboliti secondari con attività biologica e farmaceutica, dalla vitamina E agli oppioidi. Ma il vecchio percorso produce solo piccole quantità di questi composti, in parte perché devono competere per gli atomi di carbonio con il goloso processo per produrre la lignina, i polimeri duri che permettono alle piante di stare in piedi.
La scoperta della nuova via per produrre la tirosina è molto meno vincolata di quella vecchia. Ciò aumenta la possibilità che il flusso di carbonio possa essere diretto lontano dalla lignina, aumentare la resa di farmaci o sostanze nutritive a livelli che ne consentirebbero la produzione in quantità commerciali.
Una storia di due enzimi
La tirosina viene prodotta in una catena di montaggio chiamata percorso shikimate, una via metabolica in sette fasi che le piante usano per produrre i tre amminoacidi che hanno anelli aromatici. Gli animali (comprese le persone) hanno perso la capacità di erigere questa catena di montaggio nel profondo del passato evolutivo. Poiché non possiamo produrre questi amminoacidi da soli e sono essenziali per la vita, dobbiamo invece ottenerli mangiando piante o funghi.
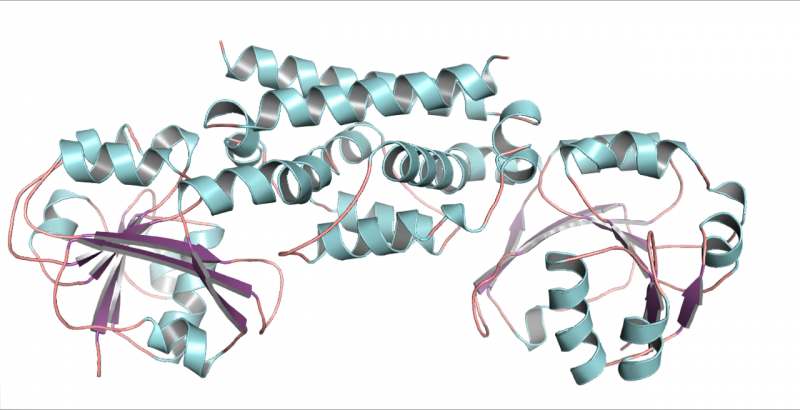
Una struttura tridimensionale dell'enzima PDH dalla soia, un legume. Questa struttura ha aiutato a dimostrare che solo una mutazione ha permesso ai legumi di evolvere un nuovo modo di produrre l'aminoacido tirosina. Credito:Craig Schenck
Quell'anello aromatico è importante, disse Jez, perché è una struttura distintiva in grado di assorbire luce o energia. Quindi gli amminoacidi aromatici sono anche i precursori di molti metaboliti secondari che catturano la luce, trasferire elettroni, o fiori colorati. Inoltre, gli amminoacidi aromatici sono anche precursori di sostanze chimiche che avvelenano altre piante o predatori di piante e attirano gli impollinatori. Molte droghe medicinali includono un anello aromatico, Jez ha commentato.
Nella maggior parte delle piante la via dello shikimate è nel cloroplasto, l'organello che fa il lavoro di convertire l'energia della luce solare in energia immagazzinata nei legami di carbonio. Una volta fatto, però, la tirosina può essere esportata dal citosol per l'incorporazione o la conversione in altri composti.
Nell'ultimo passaggio di un ramo del percorso un enzima chiamato arogenato deidrogenasi (ADH), catalizza una reazione che trasforma il composto arogenato in tirosina. L'enzima ADH è considerato "regolatore" perché è un collo di bottiglia nella produzione di tirosina. Deve competere per il substrato arogenato con il ramo della via shikimate che produce un diverso amminoacido aromatico ed è fortemente inibito dall'accumulo di tirosina
L'attività dell'ADH è comune nelle piante, ma nel corso dello studio della via dello shikimate, il laboratorio Maeda ha scoperto che le sequenze di DNA che codificano per l'ADH in alcune piante da fiore erano significativamente diverse da quelle della maggior parte delle piante. Hanno chiamato gli enzimi prodotti da queste sequenze ADH non canonico. Quindi, nel 2014, hanno riferito che alcuni legumi producono anche tirosina con un enzima diverso, chiamato prefenato deidrogenasi (PDH).
PDH differisce da ADH in molti modi. È attivo al di fuori del cloroplasto, agisce sul substrato prefenato piuttosto che sull'arogenato, perché è al di fuori del cloroplasto non deve competere per il suo substrato con altri rami della via dello shikimate, e non è inibito dall'aumento dei livelli di tirosina.
Perché ci sono due diverse linee di assemblaggio per la tirosina? Gli scienziati ritengono che l'enzima PDH si sia evoluto attraverso due eventi di duplicazione genica e l'accumulo di mutazioni nelle copie "extra" del gene. Il primo evento ha dato origine a ADH non standard in alcune piante da fiore e il secondo a PDH in un sottoinsieme di legumi. Ma perché è successo questo?
Non è una domanda a cui gli scienziati possono ancora rispondere se non in termini generali, ha detto Jez. cosa spicca, però, è che la via metabolica più recentemente evoluta non è strettamente regolata e potrebbe potenzialmente sfornare prodotti a un ritmo frenetico. Forse i legumi avevano un disperato bisogno di metaboliti secondari per qualche motivo. È certamente sospetto che i legumi abbiano un'ecologia del tutto diversa da quella di altre piante, poiché vivono in simbiosi con i batteri che fissano l'azoto.
Giocherellare i bit
A questo punto gli scienziati sapevano che il nuovo enzima, PDH, legato un substrato diverso rispetto all'enzima originale, ADHD. Sapevano anche che PDH, a differenza dell'ADH, non ha legato la tirosina stessa. Ma quali cambiamenti nella struttura hanno portato a queste differenze nell'attività chimica?
Per scoprirlo, Craig Schenck, uno studente laureato nel laboratorio Maeda, confrontato le sequenze geniche per l'enzima ADH o PDH in molte piante diverse, scelti con cura per essere ai confini del passaggio da un enzima all'altro. Ma hanno riscontrato un problema. C'erano abbastanza differenze nel DNA che era difficile vedere cosa fosse rilevante, ha detto Jez.
Incontro con Maeda a una conferenza, Jez si è offerto di provare a cristallizzare i nuovi enzimi in modo che la loro struttura potesse essere ricostruita dalle immagini a raggi X. La sua studentessa Cynthia Holland è stata in grado di cristallizzare la soia PDH e produrre immagini dettagliate della sua forma tridimensionale.
"Una volta che hai guardato la struttura, hai potuto vedere che c'erano solo due differenze dal tipico ADH trovato nella maggior parte delle piante e solo una delle differenze ha effettivamente cambiato le cose, " disse Jez. Sorprendentemente quella differenza era un singolo amminoacido nel sito attivo dell'enzima. In quel punto l'asparagina aveva sostituito l'acido aspartico.
Schenck ha ricontrollato questa intuizione strutturale capovolgendo quell'amminoacido in forme mutanti dell'enzima. Il mutante ADH si è rivelato avere attività PDH, e il mutante PDH aveva attività ADH, proprio come la squadra aveva sospettato.
"Quell'unica differenza cambia il substrato preferito dell'enzima e la sua capacità di essere inibito dal feedback della tirosina, " disse Jez. "E se lo guardi, è letteralmente la differenza tra un atomo di azoto o un atomo di ossigeno. In queste proteine, che sono costituiti da quasi trecento amminoacidi o quarantaduecento atomi, un atomo fa la differenza. È semplicemente fantastico".
Il lavoro è importante perché dimostra che il metabolismo primario si evolve. E perché mostra come la natura ruba i macchinari dal metabolismo primario e li mette insieme per creare nuovi metaboliti secondari. Lo fanno con molta più finezza di quanto gli ingegneri genetici possano ancora gestire.
"Quando vogliamo che una pianta produca una nuova molecola, "Jez ha detto, "inseriamo un gene e speriamo che si integri con i percorsi esistenti. Non sappiamo ancora come collegare prontamente il cablaggio tra ciò che introduciamo e ciò che è già presente. Quindi è interessante vedere come la natura è riuscita a collegare il cablaggio e cambiare le cose senza romperle."