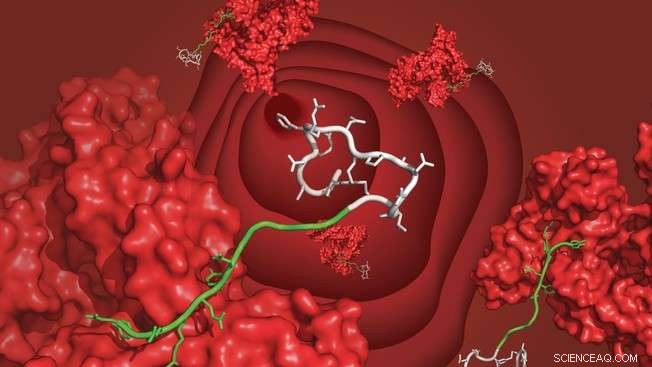
Un peptide biciclico (bianco) legato all'albumina sierica (rosso) attraverso il ligando di nuova concezione (verde), fluttuante nel flusso sanguigno. Credito:C. Heinis/EPFL
Gli scienziati dell'EPFL hanno sviluppato una molecola legante che collega i farmaci peptidici all'albumina del siero del sangue e impedisce loro di essere eliminati dai reni troppo presto. Il ligando è facile da sintetizzare e può prolungare l'emivita dei peptidi terapeutici da minuti a diversi giorni.
I peptidi sono molecole biologiche, costituito da brevi sequenze di amminoacidi. Perché sono facili da sintetizzare, mostrano bassa tossicità e alta efficienza, peptidi come l'insulina e altri ormoni possono essere usati come farmaci. Ma i peptidi vengono rapidamente eliminati dai reni, il che significa che possiamo usare solo farmaci peptidici che agiscono in pochi minuti. Questo problema può essere superato collegando i peptidi ai ligandi che legano le proteine del siero del sangue come l'albumina, permettendo al peptide di rimanere più a lungo nel flusso sanguigno. Gli scienziati dell'EPFL hanno ora sviluppato un tale ligando, che è facile da sintetizzare e ha un'alta affinità per l'albumina umana. Pubblicato in Comunicazioni sulla natura , il nuovo ligando potrebbe potenzialmente estendere l'emivita dei peptidi da minuti a diversi giorni.
I peptidi combinano una serie di caratteristiche interessanti per i farmaci:bassa tossicità e reazioni immunitarie, elevata affinità ed efficacia per i loro obiettivi, e sintesi chimica accessibile. L'unico problema è la "clearance renale":i peptidi vengono generalmente eliminati dai reni entro pochi minuti dall'ingresso nel sangue del paziente. Per esempio, uno dei peptidi più comuni, insulina, ha un'emivita del flusso sanguigno di soli 4-6 minuti. Un altro ormone, l'ossitocina, somministrata per via endovenosa per indurre o accelerare il travaglio, ha un'emivita di 10-15 minuti.
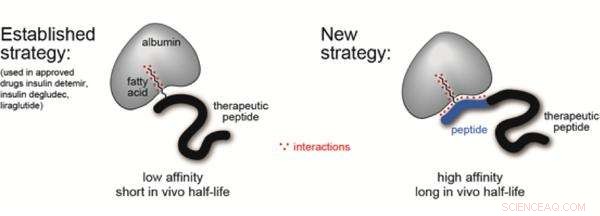
Tempi così brevi imposti dalla clearance renale limitano fortemente il potenziale terapeutico di questi farmaci potenzialmente ideali. Un modo promettente per aumentare l'emivita dei peptidi è "trasportarli" sulle proteine del siero del sangue, come l'albumina, che è la proteina più abbondante nel siero del sangue e ha un'emivita di diciannove giorni. Questo però, richiede una molecola ligando intermedia che può essere attaccata al peptide durante la sintesi, e hanno anche un'elevata affinità e selettività per l'albumina umana.
Il laboratorio di Christian Heinis all'EPFL ha ora sviluppato un tale ligando, che ha un'elevata affinità per l'albumina umana e, cosa più importante, è facile da sintetizzare e legare a un peptide. Il ligando si ottiene fondendo un acido grasso con un altro peptide. La molecola risultante viene definita "chimera" e combina il meglio di due mondi nel campo dei ligandi dell'albumina.
Credito:Ecole Polytechnique Federale de Lausanne
Sforzi precedenti hanno costruito ligandi basati su acidi grassi o peptidi, e li ho provati con l'insulina. Ma mentre gli acidi grassi allungavano in qualche modo l'emivita dell'insulina, generalmente non legano molto fortemente l'albumina. D'altra parte, i ligandi a base di peptidi legano bene l'albumina, ma ha mostrato una bassa solubilità, il che significa che non distribuiva molto bene l'insulina nel sangue.
Il nuovo ligando riunisce letteralmente i vantaggi sia degli acidi grassi che dei peptidi. I ricercatori hanno cercato una sequenza di amminoacidi che integrasse il debole legame dell'acido grasso con l'albumina. Usando un'elegante sintesi "iterativa" e un metodo di screening hanno scoperto una sequenza peptidica che aumenta il legame dell'acido grasso ventisette volte. Il ligando chimera finale lega l'albumina umana con alta affinità (Kd =39 nM), è altamente solubile, e può essere aggiunto a farmaci peptidici utilizzando tecniche di sintesi standard.
I ricercatori hanno dimostrato in vivo che il ligando prolunga l'emivita di diversi peptidi bioattivi di oltre 25 volte. Hanno quindi aggiunto il ligando a un vero peptide sviluppato per trattare la trombosi patogena, che ha una breve emivita notoriamente poco pratica. Il ligando ha dimostrato di prolungare l'efficacia del peptide di diverse ore, inibendo la malattia nei conigli.
"Ci aspettiamo che il tag presentato nel nostro lavoro interessi un pubblico più ampio di ricerca e business perché è applicabile praticamente a qualsiasi porzione peptidica, comprese le piccole proteine, " dice Heinis. "Il ligando può essere aggiunto a qualsiasi peptide durante la sintesi di peptidi in fase solida su sintetizzatori standard, rendendolo facilmente accessibile per i laboratori accademici e industriali."
L'innovativa tecnologia può potenzialmente essere applicata anche per modulare le proprietà farmacocinetiche dei peptidi biciclici sviluppati da Bicyclic Therapeutics, una startup co-fondata da Christian Heinis e Sir Greg Winter (MRC LMB Cambridge, Regno Unito) nel 2009, e di cui EPFL è azionista. Il 1 giugno di quest'anno, Bicycle Therapeutics ha ricevuto un investimento di serie B di 52 milioni di dollari USA. L'obiettivo dell'azienda è la piattaforma di prodotti del peptide biciclico (bicicletta), che combina le proprietà di più entità terapeutiche in un'unica modalità:esibire l'affinità e la farmacologia selettiva associate agli anticorpi; la cinetica di distribuzione di piccole molecole, consentendo una rapida penetrazione del tumore; e l'emivita farmacocinetica "regolabile" e la clearance renale dei peptidi.