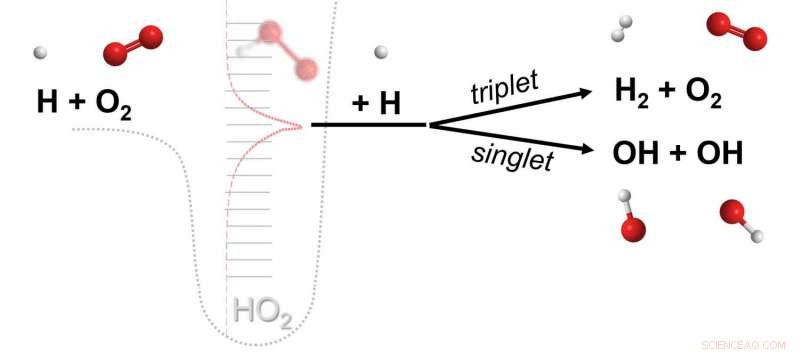
Una reazione chimica in cui tre diverse molecole (ad es. H, O2, H) ciascuno partecipa alla rottura e alla formazione di legami chimici. La reazione è mediata da un complesso di collisione effimero (HO2**) formato dalla collisione di due molecole (H, O2) che poi reagisce alla collisione con una terza molecola (H). I dati di calcoli avanzati rivelano che le reazioni di questa classe, ipotizzato quasi un secolo fa e poi ritenuto irrilevante, sono le principali vie chimiche. Credito:Michael P. Burke/Columbia Engineering
Un nuovo studio condotto da Michael P. Burke, assistente professore di ingegneria meccanica presso la Columbia Engineering, ha individuato il significato di una nuova classe di reazioni chimiche che coinvolgono tre molecole che partecipano ciascuna alla rottura e alla formazione di legami chimici. La reazione di tre diverse molecole è resa possibile da un "complesso di collisione effimero, " formato dalla collisione di due molecole, che vive abbastanza a lungo da scontrarsi con una terza molecola.
Questa quarta classe, che i ricercatori hanno chiamato "reazioni chimicamente termolecolari, " è stato ipotizzato per la prima volta da Cyril Hinshelwood e Nikolay Semenov nei loro studi sulle reazioni a catena negli anni '20 e '30 (hanno vinto il premio Nobel per la chimica nel 1956 per questo lavoro). Per decenni, i ricercatori hanno considerato queste reazioni irrilevanti, se mai si sono verificate, e fino ad ora, nessuno li ha studiati. Burke, che esplora una varietà di problemi all'interfaccia tra la chimica fisica fondamentale e i dispositivi pratici di ingegneria, deciso di indagare su queste reazioni dopo aver realizzato che le comuni situazioni di combustione, come quelli riscontrati in molti motori, hanno frazioni sufficientemente elevate di molecole altamente reattive note come radicali liberi per rendere possibili queste reazioni. Il nuovo studio è pubblicato oggi in Chimica della natura .
"La combustione è sempre stata un punto di partenza per comprendere ogni sorta di altri meccanismi chimici, "dice Burke, che è anche membro del Data Science Institute. "Potenzialmente potrebbero esserci innumerevoli reazioni da questa nuova classe che influiscono sul modo in cui modelliamo la chimica in fase gassosa, dalla progettazione di nuovi tipi di motori alla comprensione della chimica planetaria responsabile delle formazioni nuvolose, cambiamento climatico, evoluzione degli inquinanti, anche forse la sequenza di reazioni che potrebbero avere un impatto sulle condizioni per la vita extraterrestre. La nostra scoperta apre un mondo completamente nuovo di possibilità".
Per esempio, i veicoli spaziali sperimentano temperature molto elevate e frazioni radicali nella loro discesa sulla Terra. Burke ipotizza che questa quarta classe di reazioni potrebbe avere un impatto sul flusso di calore al veicolo, con implicazioni significative per la progettazione di sistemi di protezione termica per mantenere gli astronauti e/o i carichi utili al sicuro quando scendono sulla Terra.
Lavorando con Stephen J. Klippenstein, (Divisione di Scienze Chimiche e Ingegneria, Laboratorio Nazionale Argonne), Burke ha utilizzato metodi computazionali all'avanguardia, combinando calcoli di chimica quantistica che simulano la rottura e la formazione di legami chimici tra molecole che reagiscono con calcoli di trasporto cinetico che simulano le reazioni e i movimenti dei gas sfusi che governano le prestazioni dei dispositivi di ingegneria.
"La potenza di questi metodi computazionali all'avanguardia, "dice Burke, "è che possono fornire una lente unica in ambienti chimici difficili, poco adatti alle tecniche sperimentali per lo studio delle dinamiche di reazione individuali. I nostri calcoli si basano su dati computazionali prodotti dai primi principi:l'equazione di Schrödinger, l'equazione fondamentale della meccanica quantistica. La combinazione di questi dati con altri modelli basati sulla fisica ci consente di individuare direttamente l'impatto di una sola reazione tra tante, in un modo che è molto difficile da fare in laboratorio."
Utilizzando metodi teorici, compresi quelli sviluppati per questo studio, i ricercatori hanno dimostrato che queste reazioni chimicamente termolecolari (cioè tre molecole) non solo sono le principali vie chimiche, ma influiscono anche sulla velocità di propagazione della fiamma, una misura della reattività complessiva del carburante che regola le prestazioni, stabilità, e l'efficienza di molti motori moderni.
La chimica di molti sistemi, compresa la combustione e le atmosfere planetarie, è governato da complessi meccanismi chimici, dove la conversione complessiva da un insieme di reagenti iniziali a un insieme di prodotti finali passa attraverso molte molecole chimiche intermedie con molte reazioni chimiche individuali che si verificano a livello molecolare. La nostra attuale comprensione dei complessi meccanismi della combustione e delle atmosfere planetarie è stata basata sulle classi di reazioni che sono note per aver luogo. Fino ad ora, sono state considerate solo tre classi di reazioni:
Il bagno di gas è generalmente considerato un inerte, o non reattivo, molecola che non partecipa ad alcuna rottura o formazione di legami, ma invece toglie energia all'altro complesso molecolare (che avrebbe abbastanza energia cinetica interna per decomporsi spontaneamente se non venisse tolta energia).
Se invece il complesso molecolare si scontra con una molecola reattiva, quindi la terza molecola può partecipare al processo di rottura/formazione del legame, ottenendo ciò che Burke e Klippenstein chiamano un prodotto di "reazione chimicamente termolecolare". "Nel nostro giornale, abbiamo mostrato l'importanza delle reazioni che coinvolgono i complessi H + O2 con altre specie radicali, per esempio. H + O2 + H, negli ambienti di combustione, " fa notare. "Tuttavia, dato che le molecole reattive, come i radicali liberi e l'ossigeno molecolare, sono i principali costituenti nella combustione e in alcuni ambienti planetari, esiste un potenziale significativo che si verifichino altre reazioni chimicamente termolecolari e svolgano un ruolo significativo in altri ambienti".
William H. Green, professore di ingegneria chimica al MIT, dice dello studio, "È noto da tempo che molte reazioni di associazione in fase gassosa hanno tassi efficaci molto bassi, perché l'addotto energizzato iniziale non vive abbastanza a lungo da essere stabilizzato dal trasferimento di energia collisionale, e cade a pezzi di nuovo ai reagenti. Ciò ha portato il campo a pensare che questi addotti transitori possano essere completamente ignorati. Questo articolo rivela che anche se le reazioni unimolecolari degli addotti energizzati sono trascurabili, possono ancora partecipare a reazioni bimolecolari, con conseguenze sorprendentemente importanti".
Burke prevede di generalizzare queste teorie e metodi per calcolare i tassi di reazione chimicamente termolecolari per consentire calcoli simili in ambienti a pressione più elevata, dove le collisioni tra le molecole sono ancora più frequenti, importante per i progetti di motori all'avanguardia. Esplorerà anche le implicazioni della scoperta per altre reazioni e ambienti chimici, come quelli coinvolti nella formazione e riduzione degli inquinanti o la chimica delle atmosfere planetarie.