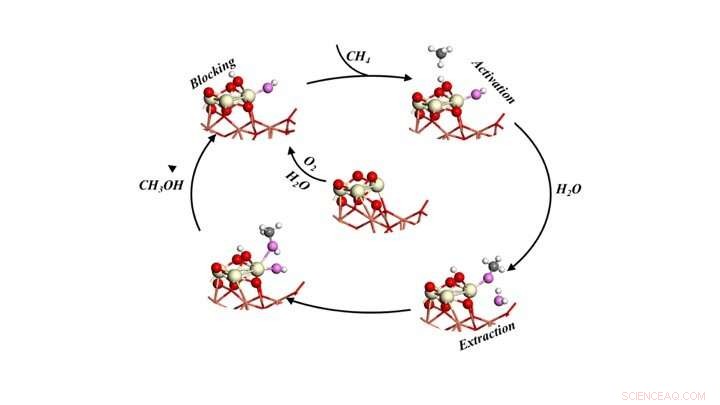
Ciclo catalitico per convertire selettivamente il metano in metanolo esponendo il metano ad ossigeno e acqua. Credito:Brookhaven National Laboratory
Scienziati del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti e collaboratori hanno rivelato nuovi dettagli che spiegano come un catalizzatore altamente selettivo converte il metano, il principale componente del gas naturale, al metanolo, un combustibile liquido facile da trasportare e materia prima per la produzione di materie plastiche, vernici, e altri prodotti di base. I risultati potrebbero aiutare la progettazione di catalizzatori ancora più efficienti/selettivi per rendere la conversione del metano un'alternativa economicamente praticabile e attraente dal punto di vista ambientale allo sfiato o alla combustione di gas "rifiuti".
Come descritto in un documento apparso in Scienza , il team ha utilizzato modelli e simulazioni basati sulla teoria per identificare i riarrangiamenti a livello atomico che si verificano durante la reazione, e poi condusse esperimenti per verificare quei dettagli. Gli studi hanno rivelato tre ruoli essenziali per l'acqua, lavorando in combinazione con un economico catalizzatore ossido di cerio/ossido di rame, per realizzare la conversione del metano in metanolo con il 70% di selettività bloccando le reazioni collaterali indesiderate.
"Sapevamo dal lavoro precedente di aver sviluppato un catalizzatore altamente selettivo per la conversione diretta del metano in metanolo in presenza di acqua, ", ha affermato il chimico del Brookhaven Lab Sanjaya Senanayake, che ha guidato il progetto. "Ma ora, utilizzando tecniche teoriche e sperimentali avanzate, abbiamo imparato perché funziona così bene".
I risultati potrebbero accelerare lo sviluppo di catalizzatori che utilizzano il metano che fuoriesce dai pozzi di gas e petrolio, dove è tipicamente scaricato direttamente nell'atmosfera o bruciato.
"Il trasporto del gas è estremamente difficile e potenzialmente pericoloso, " Ha detto Senanayake. "Ma se lo converti direttamente in un liquido puoi spostarlo e usarlo invece di svasare in modo dispendioso. Sebbene il potenziale di commercializzazione di tale reazione possa richiedere ancora diversi anni, speriamo che i nostri risultati e la comprensione di come funziona il tutto aiutino ad arrivarci più velocemente".
La teoria getta le basi
La ricerca di catalizzatori da metano a metanolo ha aperto alcune prospettive promettenti. Ma molti operano in diverse fasi distinte con requisiti energetici elevati. E in molti casi, reazioni concorrenti abbattono completamente il metano (e qualsiasi metanolo prodotto) in monossido di carbonio (CO) e CO2. Così, quando il team di Brookhaven ha osservato per la prima volta che il loro catalizzatore poteva convertire direttamente il metano in metanolo con un'elevata resa in una reazione continua, volevano saperne di più su come svolgeva questo difficile compito.
Erano particolarmente interessati a capire il ruolo dell'acqua, che sembrava facilitare i passaggi chiave del processo e in qualche modo bloccare i percorsi di reazione che producevano CO e CO2.
Utilizzando strumenti di calcolo nel Center for Functional Nanomaterials (CFN) di Brookhaven Lab, Centro di calcolo e dati scientifici di Brookhaven, Stony Brook University (SBU), e il National Energy Research Scientific Computing Center (NERSC) presso il Lawrence Berkeley National Laboratory (Berkeley Lab) del DOE, Il chimico di Brookhaven Ping Liu ha sviluppato l'approccio teorico per capire cosa stava succedendo.
Primo, ha usato i calcoli della "teoria del funzionale della densità" (DFT) per identificare come i reagenti (metano, ossigeno, e acqua) sono cambiati quando hanno interagito tra loro e il catalizzatore cerio-ossido/rame-ossido in vari stadi durante la reazione. Questi calcoli includevano anche informazioni sulla quantità di energia necessaria per passare da una disposizione atomica all'altra.
"Il DFT ti offre una serie di 'istantanee' delle fasi coinvolte nella reazione e degli 'urti' o barriere che devi superare per passare da una fase all'altra, " lei spiegò.
Quindi ha eseguito simulazioni "cinetiche di Monte Carlo", essenzialmente utilizzando i computer per provare tutti i possibili modi in cui la reazione poteva procedere da un'istantanea all'altra. Le simulazioni tengono conto di tutti i possibili percorsi e fabbisogni energetici per passare da una fase all'altra.
"Queste simulazioni iniziano con ogni fase intermedia e esaminano tutte le possibilità che possono andare alla fase successiva e capire qual è il percorso più probabile, " Liu ha detto. "Le simulazioni determinano il modo più probabile che le istantanee possono essere collegate in tempo reale".
Le simulazioni modellano anche il modo in cui le diverse condizioni di reazione, ad esempio, variazioni di pressione e temperatura, influenzeranno le velocità di reazione e le probabili vie.
"C'erano 45-50 possibili componenti nella 'rete di reazione' che stavamo simulando, " ha detto José Rodriguez, un leader del gruppo di catalisi di Brookhaven che ha anche un appuntamento congiunto presso SBU. "Di quelli, Ping, Erwei Huang, e Wenjie Liao, due dottorati studenti della SBU, sono stati in grado di prevedere quali sarebbero state le condizioni più favorevoli, la strada migliore, per passare dal metano al metanolo e non alla CO e CO2 e tutto indotto dalla presenza di acqua."
I modelli prevedevano tre ruoli per l'acqua:1) attivazione del metano (CH4) rompendo un legame carbonio-idrogeno e fornendo un gruppo -OH per convertire il frammento CH3 in metanolo, 2) bloccare i siti reattivi che potrebbero potenzialmente convertire metano e metanolo in CO e CO2, e 3) facilita lo spostamento del metanolo formato sulla superficie nella fase gassosa come prodotto.
"Tutta l'azione si svolge in uno o due siti attivi all'interfaccia tra le nanoparticelle di ossido di cerio e il film di ossido di rame che costituiscono il nostro catalizzatore, " ha detto Senanayake.
Ma questa descrizione era ancora solo un modello. Gli scienziati avevano bisogno di prove.

Brookhaven Lab e Stony Brook University (SBU) membri del team di ricerca. Prima riga, da sinistra a destra:Sanjaya Senanayake (Brookhaven), Mausumi Mahapatra (Brookhaven), José A Rodriguez (Brookhaven), Ping Liu (Brookhaven) e Wenjie Liao (SBU). Seconda fila:Ivan Orozco (SBU), Ning Rui (Brookhaven), Zongyuan Liu (Brookhaven) e Erwei Huang (SBU). Credito:Brookhaven National Laboratory
Gli esperimenti forniscono la prova
Per raccogliere prove, gli scienziati di Brookhaven e della SBU hanno condotto ulteriori esperimenti nei laboratori della divisione di chimica di Brookhaven e hanno fatto diversi viaggi all'Advanced Light Source (ALS) del Berkeley Lab. Questa squadra includeva SBU Ph.D. studente Ivan Orozco e borsisti post-dottorato Zongyuan Liu, Robert M. Palomino, Ning Rui, e Mausumi Mahapatra.
Alla SLA, il gruppo ha lavorato con Slavomir Nemsak del Berkeley Lab e i collaboratori Thomas Duchon (Peter-Grünberg-Institut in Germania) e David Grinter (Diamond Light Source nel Regno Unito) per eseguire esperimenti utilizzando la spettroscopia fotoelettronica a raggi X a pressione ambiente (AP) (XPS) , che ha permesso loro di monitorare la reazione come è avvenuta in tempo reale per identificare i passaggi chiave e gli intermedi.
"I raggi X eccitano gli elettroni, e l'energia degli elettroni ti dice quale specie chimica hai sulla superficie e lo stato chimico della specie. Crea un'"impronta digitale chimica"". Ha detto Rodriguez. "Utilizzando questa tecnica, puoi seguire la chimica della superficie e il meccanismo di reazione in tempo reale."
L'esecuzione della reazione con e senza acqua in una serie di condizioni ha confermato che l'acqua ha svolto i tre ruoli previsti. Le misurazioni hanno mostrato come le condizioni di reazione hanno portato avanti il processo e hanno massimizzato la produzione di metanolo prevenendo reazioni collaterali.
"Abbiamo trovato prove dirette della formazione di CH3O, un precursore intermedio del metanolo, in presenza di acqua, " ha detto Rodriguez. "E poiché hai l'acqua, modifichi tutta la chimica superficiale per bloccare le reazioni collaterali, e rilascia anche facilmente il metanolo dalla superficie del catalizzatore in modo che non si decomponga".
"Ora che abbiamo identificato i principi di progettazione per il catalizzatore, "Senanyake ha detto, "dopo dobbiamo costruire un vero sistema per l'utilizzo di un tale catalizzatore e testarlo e vedere se possiamo migliorarlo".