I chimici della Rice University hanno progettato una metalloproteina plug-in per semplificare il compito di realizzare terapie anticorpali mirate. I ricercatori hanno utilizzato un peptide a tripla metallizzazione (inserto) per dare una funzione specifica agli anticorpi (viola) con una testata terapeutica. Gli anticorpi modificati hanno mirato selettivamente alla superficie delle cellule del cancro al seno in laboratorio (immagine). Credito:Ball Research Group/Rice University
Gli scienziati della Rice University hanno sviluppato un metodo per modificare in modo efficiente gli anticorpi naturali in grado di fornire farmaci alle cellule bersaglio. L'aggiunta di un po' di metallo in più è la chiave.
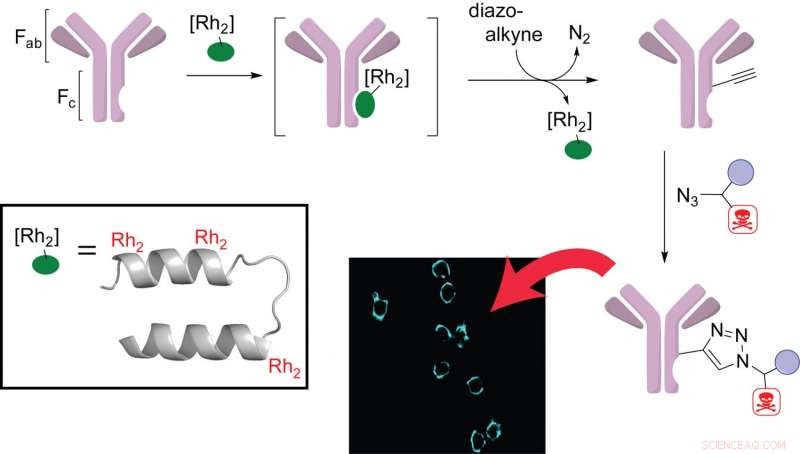
Il chimico del riso Zachary Ball e lo studente laureato e autore principale Jun Ohata hanno scoperto che il rodio, un raro metallo di transizione, può essere un elemento utile nella progettazione e preparazione di coniugati di farmaci anticorpali (trattamenti) che sono diventati uno strumento standard per la somministrazione mirata di farmaci come i chemioterapici.
Hanno sviluppato una proteina multimetallica unica che agisce come un enzima per catalizzare l'azione di un'ampia varietà di anticorpi. Il semplice processo consentirà ai laboratori di testare la funzione relativa di una varietà di fonti anticorpali e bersagli antigenici per vedere quale funzionerà meglio su una cellula tumorale.
La ricerca appare in Giornale della Società Chimica Americana .
La chiave del design di Ball e Ohata è avere tre complessi di rodio attaccati a siti specifici di una proteina che si lega alla regione dell'anticorpo costante (Fc). Una volta legato, questo peptide multimetallico catalizza l'attaccamento sito-specifico degli agenti terapeutici con un'interruzione minima dell'anticorpo stesso. Il laboratorio ha testato i suoi complessi sulle cellule del cancro al seno e ha confermato che gli anticorpi modificati conservavano le loro proprietà leganti l'antigene.
"La bellezza di questo catalizzatore è che si lega alla regione costante dell'anticorpo, quindi dovrebbe essere generalmente generale per tutti gli anticorpi umani, "disse Palla, professore associato di chimica e direttore dell'Istituto di bioscienze e bioingegneria della Rice. "Abbiamo un unico, sistema a cassetta universale che si collega agli anticorpi per creare coniugati di farmaci abbastanza rapidamente e facilmente."

Jun Ohata, studente laureato alla Rice University, trasferisce un campione di una proteina multimetallica. La proteina plug-in è progettata per semplificare il compito di effettuare terapie anticorpali mirate. Credito:Jeff Fitlow/Rice University
La tecnica ha lo scopo di semplificare quello che è stato un percorso complicato verso i coniugati di farmaci anticorpali. "Eseguire una chimica selettiva sugli anticorpi naturali senza prima ingegnerizzare le loro sequenze è stato un problema irrisolto, " Ball ha detto. "La coniugazione puramente casuale può essere preziosa, ma è difficile capire le relazioni struttura-attività quando non si dispone di un'unica struttura; si ottiene un insieme di molecole con un insieme di proprietà." Ha detto che i coniugati omogenei sono più desiderabili anche dal punto di vista normativo.
Il suo laboratorio ha una vasta esperienza con l'interazione di proteine e metalli di transizione, un gruppo di elementi al centro della tavola periodica, compreso rodio, con diversa reattività chimica.
I complessi di rodio nella metalloproteina di Ball e Ohata svolgono molteplici ruoli. "Almeno uno dei complessi di rodio si lega e aiuta a orientare correttamente il sistema, e un secondo fa la chimica che forma il legame, " ha detto Palla.
"È solo un affascinante problema chimico, " ha detto. "Abbiamo risolto molti problemi di selettività delle piccole molecole, ma quando i chimici passano a sistemi sempre più grandi, gli approcci tradizionali non sono sufficienti."
"I nostri studi in passato si sono concentrati sulla chimica per mettere qualcosa sulle proteine, ma qui abbiamo dovuto utilizzare le proteine prodotte in ulteriori studi biologici, che non avevamo mai tentato di fare prima, "Ha detto Ohata. "Mi ci sono voluti quasi due anni per finire questi esperimenti relativi alla biologia."
"Pensiamo che questa sia la frontiera della selettività chimica, " Ball ha detto. "Abbiamo questa enorme molecola che pesa 150, 000 kilodalton. Come troviamo un gruppo ossidrile in quella struttura massiccia e facciamo chimica su di esso? Queste sono il tipo di cose fondamentali a cui i chimici amano pensare".
Il laboratorio di Ball sta iniziando a lavorare con i collaboratori del Texas Medical Center per testare il nuovo catalizzatore. "Vogliamo metterli nelle mani dei medici e degli sviluppatori di farmaci per vedere cosa possono fare questi coniugati, " Egli ha detto.