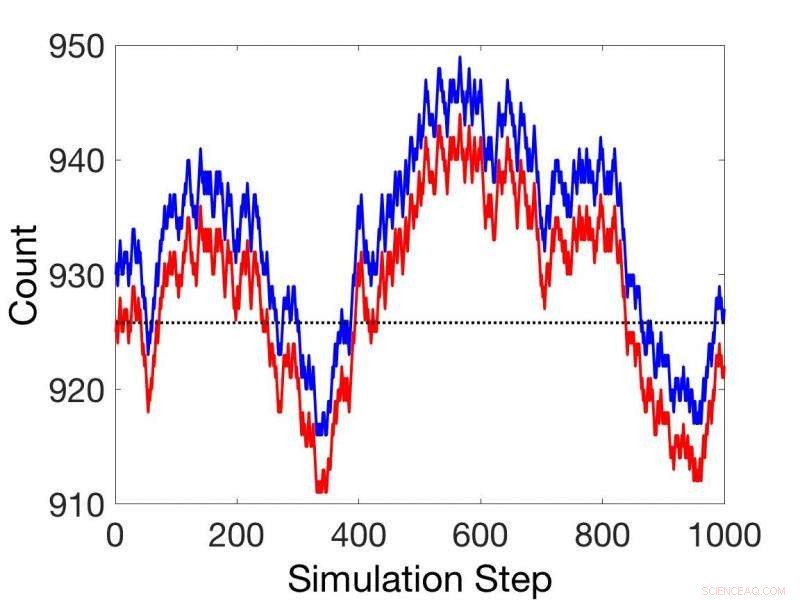
Confronti tra simulazioni cinetiche stocastiche non stazionarie (rosso) e simulazioni utilizzando il teorema della reazione accoppiata (blu). Credito:Pacific Northwest National Laboratory
La legge dell'azione di massa è stata descritta per la prima volta 150 anni fa. Oggi, è ancora un concetto base in ogni testo di chimica del primo anno. La legge afferma che la velocità di una reazione chimica è proporzionale alla concentrazione dei reagenti. Per soluzioni in equilibrio dinamico, la legge prevede come si comporteranno tali soluzioni.
Ma è una sfida applicare la legge dell'azione di massa a sistemi complessi, come il metabolismo biologico. Per uno, la maggior parte delle costanti di velocità non sono disponibili, e misurare quelli mancanti è molto laborioso.
Nella ricerca biologica, la misurazione delle costanti di velocità richiede l'isolamento e la purificazione dei singoli enzimi, quindi determinando le costanti di velocità con la spettrofotometria - cioè, da quanta luce assorbe una sostanza chimica. Questo rallenta la velocità di trasmissione, rendendo difficile caratterizzare ogni nuovo genoma. Dopotutto, per fare ciò sono necessari migliaia di parametri di velocità.
A causa di questi problemi, un gran numero di parametri di velocità enzimatica è stato determinato solo per alcuni sistemi ben descritti, come Escherichia coli. Per la maggior parte dei sistemi biologici, gli scienziati non hanno ancora ottenuto costanti di velocità.
Nel frattempo, il metodo di scelta per modellare processi biologici su larga scala (come il metabolismo) prevede modelli di flusso basati su vincoli. Ma questi modelli soffrono di una mancanza di fisica per quanto riguarda la legge dell'azione di massa, limitare la capacità degli approcci basati su vincoli anche quando sono estesi per includere la termodinamica e altri fattori.
In risposta, alcuni ricercatori hanno proposto di studiare le reazioni elementari usando la legge della reazione di massa attraverso le affinità di reazione invece delle costanti di velocità.
Un nuovo articolo sulla rivista Biologia Fisica di William R. Cannon e Scott E. Baker presso il Pacific Northwest National Laboratory esamina la relazione tra affinità di reazione ed energia libera per reazioni isolate utilizzando concetti di integrazione termodinamica statistica. Cannon e Baker si sono proposti di dimostrare esplicitamente la relazione tra formulazioni cinetiche di velocità che utilizzano costanti di velocità e una formulazione termodinamica statistica che utilizza potenziali chimici.
Successivamente presentano un teorema per reazioni accoppiate basate su potenziali chimici, che può fornire velocità relative per tutte le reazioni accoppiate in sequenza in tutte le condizioni, stato stazionario o meno. Ciò elimina la necessità di costanti di velocità in molte applicazioni.
L'uso dei potenziali chimici invece delle costanti di velocità rappresenta un salto metodologico che, secondo gli autori, potrebbe segnalare un importante progresso per la modellazione predittiva nella biologia dei sistemi.
Il nuovo metodo consentirà complessi, sistemi biologici su larga scala come il metabolismo da modellare con cinetica e termodinamica. Ciò si tradurrà in previsioni più accurate per la progettazione di microrganismi per comportarsi nei modi desiderati, come quelli che potrebbero essere sfruttati per produrre biocarburanti.
Inoltre, dicono gli autori, il nuovo metodo fornirà informazioni fondamentali sull'accoppiamento termodinamico tra gli organismi viventi e il loro ambiente.