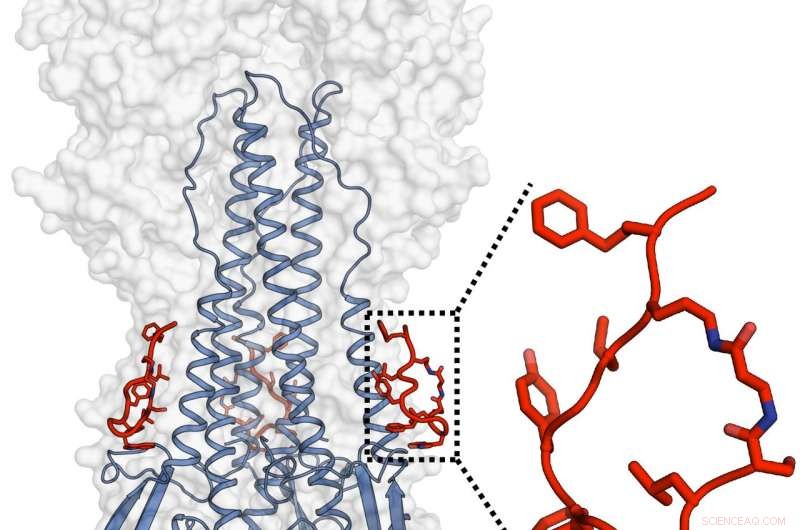
I team di Janssen e TSRI hanno progettato e caratterizzato un potente peptide che imitava la funzionalità di un anticorpo ampiamente neutralizzante e che era anche in grado di colpire l'emoagglutinina del virus dell'influenza. Credito:Rameshwar U. Kadam (Laboratorio di Ian Wilson)
Un team di ricercatori dello Scripps Research Institute (TSRI) e Janssen Research &Development (Janssen) ha ideato molecole di peptidi artificiali che neutralizzano un'ampia gamma di ceppi di virus dell'influenza. I peptidi sono brevi catene di amminoacidi, come le proteine, ma con strutture più semplici. Queste molecole progettate hanno il potenziale per essere sviluppate in medicinali che colpiscono l'influenza, che provoca fino a 500, 000 morti in tutto il mondo ogni anno e costa agli americani miliardi di dollari in giorni di malattia e perdita di produttività.
I peptidi sviluppati bloccano l'infettività della maggior parte dei ceppi circolanti di virus dell'influenza A del gruppo 1, compreso H5N1, un ceppo di influenza aviaria che ha causato centinaia di infezioni e decessi umani in Asia, e il ceppo di influenza suina H1N1 che ha causato una pandemia globale nel 2009-10.
Gli scienziati hanno progettato i peptidi per imitare le regioni di presa del virus di due "super-anticorpi" scoperti di recente che sono noti per neutralizzare praticamente tutti i ceppi di influenza A. Gli anticorpi sono grandi proteine che sono costose da produrre e devono essere somministrate per iniezione o infusione. Invece, "i peptidi sviluppati nello studio hanno il potenziale per essere farmaci somministrati tramite farmaci a base di pillola in futuro".
"Creare piccole molecole che fanno essenzialmente ciò che queste più grandi, gli anticorpi ampiamente neutralizzanti fanno è una strategia davvero eccitante e promettente contro l'influenza, come mostrano i nostri nuovi risultati, " ha detto il co-investigatore senior Ian Wilson, Hansen Professore di Biologia Strutturale al TSRI.
Il rapporto sui nuovi peptidi è apparso come un documento di prima versione online in Scienza il 28 settembre, 2017.
I due super-anticorpi anti-influenzali su cui si basano questi peptidi, chiamato FI6v3 e CR9114, sono stati scoperti nel 2011 e nel 2012. Da allora, Il laboratorio di Wilson al TSRI, in collaborazione con Janssen e altri laboratori di biologia strutturale in tutto il mondo, hanno mappato su scala atomica come questi e altri anticorpi ampiamente neutralizzanti si legano ai virus dell'influenza.
Un gruppo di ricerca guidato da David Baker dell'Università di Washington ha recentemente utilizzato questi dati sulla struttura anticorpale per progettare nuove proteine, più piccolo degli anticorpi, che si legano ai virus dell'influenza in modo simile e neutralizzano un'ampia gamma di ceppi influenzali. Il nuovo sforzo del TSRI in collaborazione con gli scienziati di Janssen mirava allo sviluppo di molecole non proteiche ancora più piccole che colpirebbero la stessa regione bersaglio sui virus dell'influenza.
Dopo diversi cicli di progettazione e sintesi molecolare, test di associazione di virus, e valutazione strutturale a livello atomico, il team di ricerca ha sviluppato una serie di quattro peptidi con forma circolare, strutture "cicliche" che si sono comportate bene come potenziali molecole bloccanti l'influenza.
I peptidi hanno mostrato un'elevata affinità di legame per un'ampia gamma di virus dell'influenza A del gruppo 1, così come una potente capacità di neutralizzare le infezioni con questi virus negli esperimenti di laboratorio. I virus dell'influenza A del gruppo 1 mirati includono H1, H2, Sottotipi H5 e H6.
I peptidi incorporavano anche blocchi di aminoacidi che non si trovano nelle proteine naturali, e questo, così come le loro strutture cicliche, li ha resi relativamente resistenti agli enzimi che altrimenti possono eliminare rapidamente i farmaci peptidici dal flusso sanguigno. Il più ottimizzato dei quattro peptidi, chiamato P7, è sopravvissuto per ore se esposto al plasma sanguigno di topo o umano, o quando iniettato nei topi.
"Questi peptidi hanno una stabilità simile a quella dei farmaci e saranno buoni candidati per ulteriori test sull'efficacia antivirale in modelli animali, " ha detto Rameshwar U. Kadam, un ricercatore postdottorato senior presso il Wilson Laboratory che è co-primo autore dello studio insieme a Jarek Juraszek, Principal Scientist presso Janssen.
I peptidi, come gli anticorpi che sono progettati per imitare, si legano a un sito noto come solco dello stelo idrofobo nella parte inferiore dell'emoagglutinina, la principale proteina dell'involucro del virus dell'influenza. La struttura molecolare in questo sito non tende a variare molto tra i ceppi influenzali perché svolge un ruolo cruciale in un processo di cambiamento di forma che consente al virus di penetrare nella cellula ospite e avviare l'infezione. Le valutazioni strutturali di Kadam hanno scoperto che i peptidi impediscono questo cambiamento di forma e quindi impediscono la penetrazione della cellula ospite.
"Una terapia mirata alla prima fase dell'infezione integrerebbe i farmaci antinfluenzali esistenti che mirano alle fasi successive dell'infezione, " disse Kadam.
I peptidi non si legano al loro bersaglio virale in modo così completo come gli anticorpi su cui si basano. Sui virus dell'influenza A del gruppo 2, Per esempio, non avevano la capacità degli anticorpi più voluminosi di spingere da parte o evitare una molecola di zucchero sull'emoagglutinina che blocca una parte chiave del sito bersaglio. Però, Kadam ha affermato che ulteriori studi potrebbero produrre peptidi con attività contro l'influenza A sia di gruppo 1 che di gruppo 2 e persino i ceppi di influenza B.
"È piuttosto rivoluzionario che siamo stati in grado di utilizzare le informazioni strutturali sugli anticorpi per creare molecole molto più piccole che hanno quasi la stessa affinità di legame e ampiezza di neutralizzazione contro i virus dell'influenza, " disse Kadam.
"C'è stato scetticismo nel campo sul fatto che potremmo ottenere risultati così buoni con molecole così piccole, ma questo studio dimostra che possiamo, " disse Wilson.