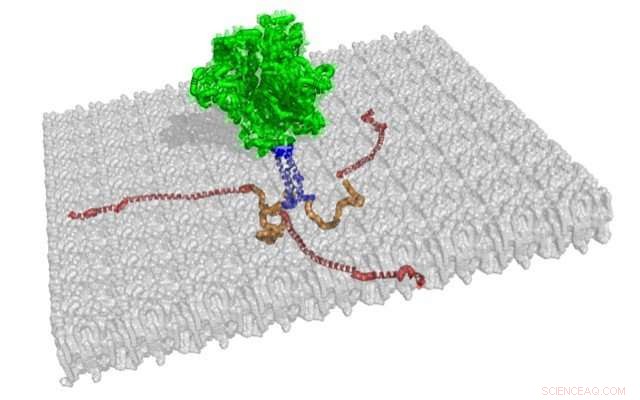
Le strutture di tre code citoplasmatiche associate alla membrana di gp41 sono mostrate in rosso e arancione, da questa illustrazione della struttura a spiga trimerica. Il resto di questa proteina dell'involucro dell'HIV-1, che è ancorato su una membrana grigia, sono le strutture di gp120 e gp41, mostrato in verde, e il segmento transmembrana, mostrato in blu. Attestazione:Jamil Saad
Un team dell'Università dell'Alabama a Birmingham guidato da Jamil Saad, dottorato di ricerca, ha risolto l'ultima struttura proteica sconosciuta dell'HIV-1, il retrovirus che può causare l'AIDS.
La conoscenza di questa struttura, chiamata coda citoplasmatica della proteina gp41, aiuterà i ricercatori a comprendere ulteriormente come il virus infetta le cellule umane e come i virus della progenie vengono assemblati e rilasciati dalle cellule infette. La coda citoplasmatica sembra svolgere un ruolo chiave nell'assemblaggio del virus per aiutare a incorporare le strutture dei picchi dell'involucro nella superficie delle particelle virali.
"Se siamo in grado di inibire l'incorporazione della proteina dell'involucro, inibiamo la replicazione virale, " Ha detto Saad. "Questo disarmerebbe il virus e preverrebbe la malattia. La coda citoplasmatica è una componente critica dell'infettività".
La struttura della coda citoplasmatica di gp41 era un compito tremendamente difficile da risolvere, dice Saad, professore associato di microbiologia all'UAB.
"È stato il progetto più impegnativo che ho incontrato negli ultimi 20 anni. Molte volte stavo per smettere, ma ho un gruppo di laboratorio molto persistente."
Saad conosce molti altri gruppi di ricerca che non sono stati in grado di determinare la struttura molecolare.
Un problema per Saad e i suoi colleghi UAB si è presentato mentre cercavano di esprimere la coda citoplasmatica di gp41 nelle cellule in crescita di E. coli. Invece di prodotto intatto, un enzima batterico stava tagliando la proteina durante l'espressione della proteina. "Non l'abbiamo mai visto per nessun'altra proteina, " Ha detto Saad. I ricercatori hanno scoperto che dovevano limitare l'espressione delle proteine a sole due ore. Anche allora, Il 70 percento della coda citoplasmatica è stato tagliato e solo il 30 percento è rimasto intatto.
Ci sono voluti più di due anni e sforzi con 100 condizioni diverse per ottenere un buon prodotto, dice Saad. "Ora possiamo farcela in due giorni."
Il taglio si è rivelato utile. Un pezzo era solubile, e il gruppo Saad è stato in grado di esaminarne la struttura utilizzando la risonanza magnetica nucleare, o RMN. L'altro pezzo era insolubile, quindi i ricercatori hanno dovuto utilizzare una soluzione di micelle, lipidi dispersi o aggregati simili a detergenti in una soluzione, per consentire al pezzo insolubile di formare la sua struttura all'interno di un ambiente simile a una membrana. Come le condizioni di crescita, i ricercatori avevano bisogno di molte prove per trovare le condizioni adeguate della membrana. Una soluzione micella è in qualche modo simile all'aceto e all'olio dopo averla agitata con forza per disperdere minuscole goccioline di olio in tutta la medicazione.
Ancora, L'NMR è stato utilizzato per risolvere la struttura insolubile mentre era incorporata nelle micelle.
Quando il gruppo Saad mette le molecole dell'intatto, coda citoplasmatica a tutta lunghezza di gp41 nella soluzione micellare, hanno scoperto che le strutture di ciascuno dei pezzi sono state mantenute nella struttura intatta.
Hanno scoperto che l'estremità N-terminale della coda citoplasmatica di gp41, misurando 45 residui di amminoacidi, mancava di una struttura secondaria regolare e non era associata alla membrana, che avvolge una particella virale dell'HIV-1 come il rivestimento in pelle di una palla da baseball. L'estremità C-terminale della coda citoplasmatica di gp41, misurando 105 residui di amminoacidi, era strettamente associato alla membrana e presentava tre alfa-eliche con porzioni idrofobe e porzioni idrofile. Il gruppo UAB ha anche mostrato la topologia preferita della coda citoplasmatica quando legata alla membrana.
Saad afferma che la struttura apre aree di ricerca completamente nuove:come la coda citoplasmatica stabilizza la struttura proteica dell'involucro, come influenza la mobilità della membrana della struttura proteica dell'involucro, e come aiuta a coordinare il legame di membrana e l'associazione di 2, 000 poliproteine HIV-1 Gag sotto la superficie della membrana. Le poliproteine Gag vengono successivamente tagliate all'interno del virus in maturazione per formare matrici multiple più piccole, proteine del capside e nucleocapside che producono il nucleo virale condensato.
Saad afferma che la conoscenza della struttura della coda citoplasmatica gp41 aprirà anche studi comparativi di 10 diversi retrovirus che hanno code simili per capire perché alcune code sono più corte e alcune code sono più lunghe.
"La coda citoplasmatica di gp41 è stata di interesse per molto tempo, e nessuno capisce come funziona nell'infezione o come aiuta a incorporare la proteina dell'involucro nella membrana, " Ha detto Saad.