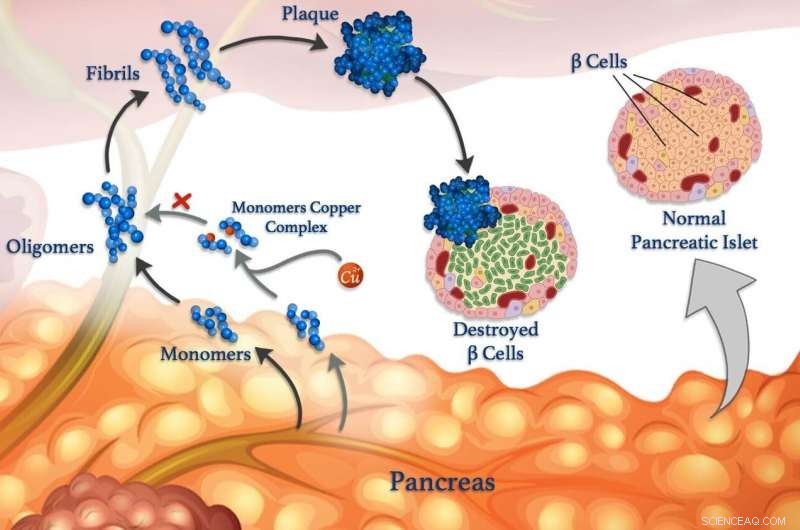
Gli ioni di rame (sfere rosse) possono legarsi ai monomeri peptidici (blu) e impedire loro di aggregarsi per formare oligomeri, fibrille e placche dannose. © 2020 Mawadda Alghrably
Svelare le interazioni tra ioni metallici e peptidi nel corpo può eventualmente portare a migliori trattamenti per il diabete, Alzheimer e altre malattie. La comprensione di queste interazioni è al centro della ricerca, co-guidato da KAUST, che sta rivelando come i metalli, come il rame, può influenzare la formazione di ammassi dannosi di cluster peptidici mal ripiegati chiamati fibrille, che sono alla base di molte malattie.
I peptidi erranti sono collegati a condizioni neurologiche come l'Alzheimer, così come al diabete di malattia di controllo della glicemia. I livelli di zucchero nel sangue sono normalmente controllati tramite ormoni peptidici rilasciati da cellule specializzate chiamate cellule . Oltre all'insulina, le cellule beta sane rilasciano anche amilina, un ormone peptidico che aiuta a ridurre i picchi di zucchero nel sangue dopo aver mangiato rallentando lo svuotamento dello stomaco. Ma l'amilina è incline a formare grumi piegati male, soprattutto in presenza di ioni rame, che danneggiano le cellule β e contribuiscono al diabete di tipo II.
Però, gli ioni metallici possono anche contrastare l'aggregazione dei peptidi in alcune circostanze, afferma il ricercatore KAUST, Mariusz Jaremko, che ha guidato il lavoro in collaborazione con i ricercatori dell'Università di Wroclaw in Polonia. Per studiare il processo in modo più dettagliato, il team sta esaminando l'interazione tra gli ioni rame(II) e l'amilina ei suoi analoghi molecolari. "Tale conoscenza ci darebbe informazioni sui meccanismi molecolari del diabete di tipo II, permettendoci di progettare nuove strategie e terapie contro questa malattia, " dice Jaremko.
Nel loro ultimo lavoro, il team ha studiato l'influenza degli ioni rame sull'aggregazione di due analoghi dell'amilina umana:un farmaco che imita l'amilina chiamato pramlintide e l'amilina dei ratti. "Abbiamo scoperto che le differenze nelle strutture di pramlintide e amilina di ratto significano che gli ioni di rame impediscono l'aggregazione di pramlintide, ma non amilina di topo, "dice Mawadda Alghrably, un dottorato di ricerca studente nella squadra di Jaremko.
I ricercatori hanno studiato il processo utilizzando più tecniche, inclusa la risonanza magnetica nucleare (in collaborazione con Abdul-Hamid Emwas di KAUST CoreLabs), e un saggio di fluorescenza "thioflavin T" di aggregazione proteica. Hanno scoperto che sebbene entrambi gli analoghi dell'amilina leghino il rame, pramlintide potrebbe legarlo in due modi diversi a causa di un ulteriore amminoacido istidina legante il rame che è presente nel pramlintide ma non nell'amilina di ratto. Il legame dello ione rame con questa istidina probabilmente spiegava perché il rame riduceva l'aggregazione di pramlintide ma non l'aggregazione di amilina di ratto, hanno concluso i ricercatori.
Il team sta continuando a decifrare le basi molecolari dell'aggregazione dell'amilina, Alghrabilmente dice. "Capire come si comportano queste molecole, potrebbe in definitiva aiutare a facilitare la progettazione di nuovi farmaci e terapie efficaci per il diabete di tipo II, " lei dice.