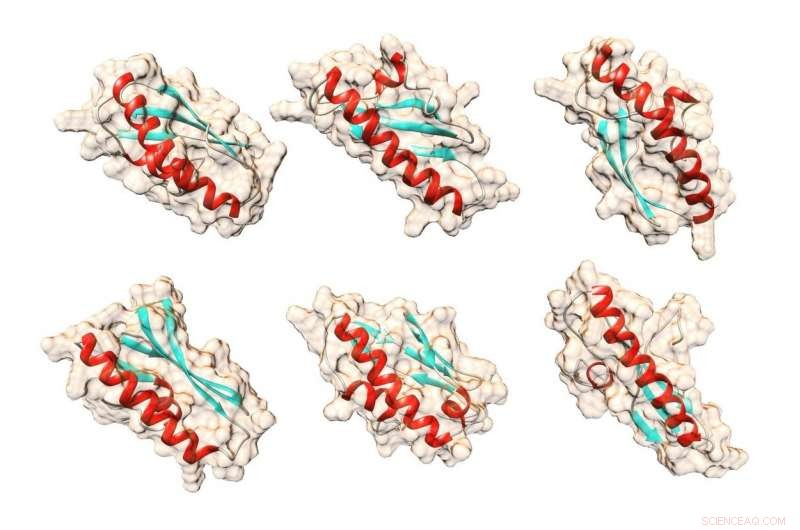
Possibili forme per la proteina di lievito Bsc4 che l'algoritmo del computer QUARK ha previsto utilizzando solo le sequenze di amminoacidi della proteina. Credito:Matthew Cordes, utilizzando il pacchetto di grafica molecolare UCSF Chimera
Una proteina di lievito che si è evoluta da zero può piegarsi in una forma tridimensionale, contrariamente alla comprensione generale delle giovani proteine, secondo una nuova ricerca condotta dall'Università dell'Arizona.
Gli scienziati pensavano che queste proteine appena evolute fossero lavori in corso che non potevano piegarsi in forme complesse come fanno le proteine più antiche.
"Questo nuovo studio del nostro laboratorio fornisce la primissima prova che una proteina evolutasi di recente da zero può infatti piegarsi in una forma tridimensionale compatta, " ha detto l'autore senior Matthew Cordes, un professore associato di chimica e biochimica UA.
"Ciò che abbiamo scoperto non si presenta come una molecola biologica completamente sviluppata. Sembra come sembrerebbe una proteina appena nata, forse un po' goffa o formata confusamente, "disse Cordes, un membro dell'Istituto BIO5 dell'UA. "Ma comunque, questa proteina si ripiega in una struttura tridimensionale e sotto molti aspetti sembra proteine che si sono evolute molto tempo fa.
"È sorprendente quando lo guardo. Mi sento davvero come se stessi vedendo uscire qualcosa".
Prove recenti suggeriscono che nuovi geni possono derivare dalle sezioni non codificanti, o "spazzatura, "Dna e che quei nuovi geni potrebbero codificare per proteine nuove di zecca. I geni codificano per proteine, le molecole che funzionano all'interno delle cellule.
La coautrice Joanna Masel ha dichiarato:"Non tutti i geni sono antichi e quelli che non sono antichi non vengono studiati molto".
Cordes è la prima persona a guardare la struttura della proteina che risulta da un gene che è sorto di recente da DNA spazzatura, disse Masel, un professore UA di ecologia e biologia evolutiva e membro dell'Istituto BIO5.
Perché cambiare un gene esistente sembrava più facile che inventarne uno completamente nuovo, gli scienziati avevano pensato che fossero sorti nuovi geni modificando duplicati di geni esistenti.
"La storia è che l'evoluzione non è solo un armeggiare che rielabora ciò che ha, a volte l'evoluzione inventa un funzionale completamente nuovo, molecola strutturata, " disse Cordes.
Il documento di ricerca del team, "Piegabilità di una proteina naturale evoluta De Novo, " è online sulla rivista Struttura e prevista per la pubblicazione nel mese di novembre. I coautori di Cordes e Masel sono Dixie Bungard, Jacob Coppola, Jimmy Chun, Vlad Kumirov e Scott Foy dell'UA e Jing Yan e Vicki Wysocki dell'Ohio State University di Columbus.
Il National Institutes of Health concede GM104040, GM113658, ES06694, CA023074 e 1S10 RR028868-01 e una sovvenzione della John Templeton Foundation hanno finanziato la ricerca.
Gli scienziati sanno da più di un decennio che alcuni geni sembrano nascere nuovi di zecca, o de novo, dal DNA spazzatura.
Però, si sa poco delle proteine per le quali tali geni codificano, disse Cordes, che studia l'evoluzione della struttura e della funzione delle proteine.

Matthew H.J. Cordes, un professore associato di chimica e biochimica dell'Università dell'Arizona, studia l'evoluzione della struttura e della funzione delle proteine. Credito:Beatriz Verdugo, Notizie sull'UA
"Il mio obiettivo è vedere che aspetto hanno queste proteine, " Egli ha detto.
Cordes e i suoi colleghi hanno studiato una proteina prodotta da un ceppo di laboratorio di lievito di birra utilizzando un gene de novo. Il gene BSC4 e la sua proteina risultante Bsc4 sembrano aiutare nella riparazione del DNA.
Il primo passo nello studio di una proteina è farne molto. Il team di Cordes ha utilizzato un metodo standard:ha inserito il gene BSC4 nei batteri di E. coli e ha fatto in modo che i batteri fungessero da fabbrica per la produzione di proteine. Alcune aziende farmaceutiche usano lo stesso metodo per produrre insulina per le persone con diabete.
Il prossimo passo è purificare la proteina, che per Bsc4 non era mai stato fatto prima, ha detto Cordes.
"C'è stata una vera mancanza di persone che purificano i prodotti di questi geni de novo e li esaminano. Questo è il vuoto che stiamo cercando di colmare, " Egli ha detto.
ordinariamente, i ricercatori poi cristallizzano la proteina e creano una descrizione dettagliata della struttura della proteina utilizzando tecniche di imaging ad alta risoluzione.
Però, la proteina del bambino non era facile da lavorare, ha detto Cordes. La squadra non è riuscita a cristallizzarlo.
Il team ha determinato informazioni generali sulla forma e la struttura della proteina. Il gene BSC4 codifica per una piccola catena di amminoacidi, o catena polipeptidica.
Nella proteina risultante, Bsc4, molte di queste catene si uniscono. La proteina può esistere come due o tre catene, ma anche come gruppi di molte catene. Avere una tale varietà di dimensioni non è tipico, ha detto Cordes.
"La maggior parte delle proteine naturali esiste in una certa dimensione, " ha detto. "Questo può essere in gruppi di quattro, cinque, sei, sette - questo è uno dei motivi per cui potresti chiamare la struttura sfocata o rudimentale".
La proteina presenta altre caratteristiche delle proteine normali, compresa la piegatura in forme standard come alfa eliche e fogli pieghettati beta. Inoltre, la proteina si dispiegherà, o denaturare, in determinate condizioni e può quindi essere riportato al suo stato ripiegato. La parte bianca soda di un uovo cotto è proteina denaturata dell'albume.
"Per molti anni, la gente pensava che le proteine dovessero avere queste eleganti strutture simili a origami per funzionare, ma è diventato chiaro che possono avere disordine, possono avere proprietà fuse e continuare a fare cose in un organismo, " Egli ha detto.
Cordes ha caratterizzato Bsc4 come "globulare" e ha detto che la maggior parte delle proteine globulari naturali ha una sola forma standard. Chiama la proteina "globulare fusa" perché può cambiare forma.
"Si pensa che la proteina sia coinvolta nella riparazione del DNA e potrebbe essere coinvolta nel legame del DNA. Può essere che la sua struttura attuale sia perfettamente adatta a ciò che deve fare, " Egli ha detto.
"Non essere emerso come questa gloriosa opera d'arte rende più credibile che questi geni codificanti proteine stiano spuntando fuori dalla regione genetica tra i geni, " Cordes ha detto. "Voglio sapere da dove vengono le cose nella vita - come la vita crea novità, come l'evoluzione crea novità."