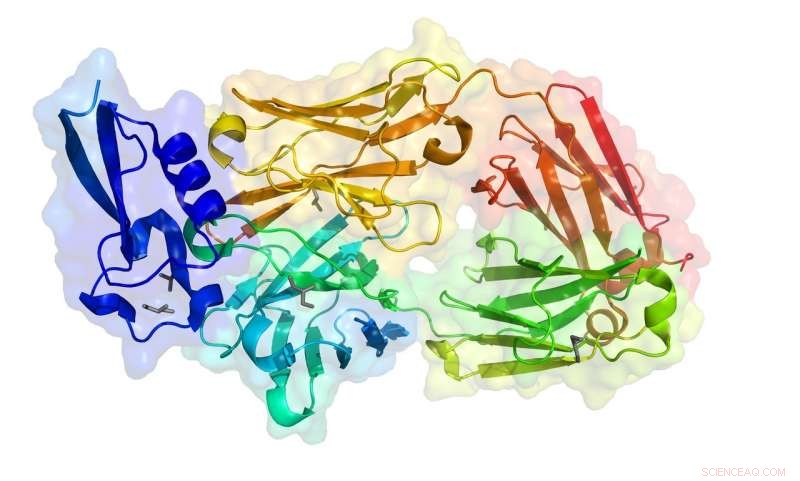
ID PDB:6B0S
La Canadian Light Source celebra due traguardi raggiunti dagli scienziati che hanno condotto ricerche presso la struttura nazionale dell'Università del Saskatchewan.
Gli scienziati hanno risolto 1, 000 strutture proteiche utilizzando i dati raccolti presso le linee di luce CMCF di CLS. Questi sono stati aggiunti alla Protein Data Bank, una raccolta di strutture risolte dai ricercatori di tutto il mondo. I ricercatori hanno anche pubblicato 500 articoli scientifici basati sul loro lavoro utilizzando le linee di luce della cristallografia.
Le proteine sono gli elementi costitutivi della vita e sono descritte come i cavalli di battaglia del corpo. Il corpo è composto da trilioni di cellule. Le cellule producono proteine, che fanno il lavoro di scomporre il cibo, inviare messaggi ad altre celle, e combattere i batteri, virus e parassiti. Le scoperte al CLS vanno dal modo in cui il parassita della malaria invade i globuli rossi al motivo per cui i superbatteri sono resistenti a determinati antibiotici e al modo in cui le mutazioni della proteina parkina provocano alcuni tipi di malattia di Parkinson. Comprendere come funzionano queste e altre proteine simili può potenzialmente salvare milioni di vite.
"Ognuna di queste strutture proteiche che sono state risolte al CLS rappresenta un contributo significativo al corpo globale di conoscenze nei settori della biologia e della biochimica, l'avanzamento della ricerca sanitaria, ", afferma il CEO Rob Lamb.
"Siamo orgogliosi di questi traguardi, e il duro lavoro e la dedizione che ci sono voluti per realizzarli. Gli scienziati provengono da tutto il Canada e da tutto il mondo per utilizzare la nostra struttura all'avanguardia supportata da fantastici scienziati del personale".
Utilizzando una potente luce a raggi X di sincrotrone, gli scienziati esplorano l'essere umano, animale, pianta, batterico, proteine virali e parassitarie e acidi nucleici. Dopo aver esposto un cristallo proteico alla luce di sincrotrone, gli scienziati sono in grado di utilizzare le informazioni per produrre un modello 3D che mostra le posizioni degli atomi. Queste informazioni strutturali forniscono dettagli su come le proteine funzionano e interagiscono. Gli scienziati utilizzano quindi queste informazioni per comprendere meglio la biologia, processi ambientali, così come la salute e le malattie umane. Spesso, usano le informazioni per sviluppare nuovi farmaci.
"Queste linee di luce sono un enorme impulso per la comunità biologica strutturale canadese, "dice Miroslaw Cygler, Professore di biochimica dell'Università del Saskatchewan e cattedra di ricerca canadese in medicina molecolare con luce di sincrotrone. È anche il leader del team di consulenza della beamline CMCF.
"Ogni laboratorio di cristallografia proteica in Canada, da costa a costa a costa, utilizza questa struttura per fare esperimenti. Il Canada è un paese grande. Viaggiare è molto costoso. Fin dall'inizio, una delle missioni della struttura era quella di fornire un servizio remoto. Questo è davvero cruciale sia per l'impatto che per l'importanza per i canadesi, "dice Cygler.
Jean-Philippe Julien non potrebbe essere più d'accordo. Julien è il Canada Research Chair in Structural Immunology e uno scienziato in Molecular Medicine presso l'Hospital for Sick Children Research Institute, nonché assistente professore nei dipartimenti di biochimica e immunologia dell'Università di Toronto.
Negli ultimi due anni, ha risolto 20 strutture proteiche utilizzando la raccolta dati remota. Invia campioni di cristallo a Saskatoon dove gli scienziati del CLS assistono montando i campioni sulla linea di luce e poi il team di Julien utilizza l'attrezzatura dal loro laboratorio a Toronto. Structure 6B0S (crystal structure of circumsporozoite protein aTSR domain in complex with 1710 antibody) is the one-thousandth protein structure solved at the CLS and is part of Julien's research into developing a vaccine that prevents the malaria parasite from causing infections.
The World Health Organization reports that nearly half of the world's population is at risk of contracting malaria, with hundreds of thousands of children dying every year.
In collaboration with scientists in Germany, Julien's team examined B cells – a type of white blood cell – from volunteers who received a candidate malaria vaccine and were then exposed to the malaria parasite to evaluate protection in a clinical trial. By solving the protein structure of an antibody developed by one of the European volunteers in this study, Julien has learned more about how the vaccine interacted with their immune system. This provides scientists with further clues as to how to alter the vaccine to improve immunity to malaria.
"In characterizing human antibody responses to malaria antigens, it is critical to have access to a world-class synchrotron beamline within Canada, " says Julien.
"Recent upgrades to CMCF have tremendously increased the sensitivity and throughput of data collection, enabling us to solve more antigen-antibody structures informing our quest towards the design of improved malaria vaccine candidates."
Julien's research describing this latest protein structure was published this week in The Journal of Experimental Medicine .
More than 70 academic, government and industrial research groups from across Canada and the United States conduct research using the CMCF beamlines.
The number of depositions has been increasing every year and with upcoming upgrades on the beamlines, the volume of work is expected to continue to accelerate.
The 500th paper was the result of research by Cygler's laboratory at the U of S. Using crystallography as well as other techniques, the researchers have a better understanding of how iron-sulfur clusters are synthesized in the body. These clusters are key components of many proteins critical to life and defects in the formation of the clusters can cause severe neurological and metabolic diseases, often with fatal outcomes. The findings were published in Comunicazioni sulla natura .