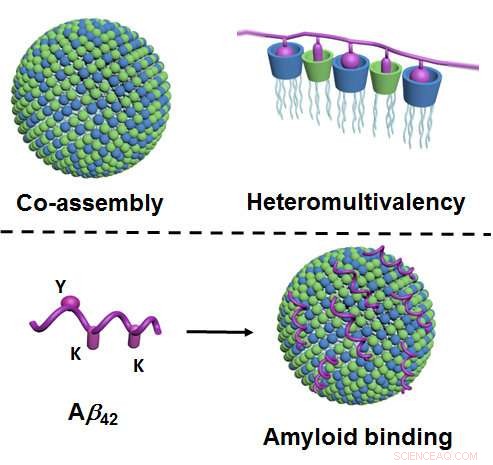
Figura in alto:tramite co-assemblaggio, due componenti di tipo lipidico formano nanoparticelle nell'acqua che hanno un numero molto elevato di punti di contatto diversi (mostrati in blu e verde; a sinistra). Come risultato di molti diversi punti di contatto che interagiscono simultaneamente con la proteina (mostrato in viola), si verifica un grado di selettività particolarmente elevato ("eteromultivalenza", Giusto). Figura in basso:tramite i loro punti di contatto (verde e blu), le nanoparticelle legano gli amiloidi - qui, nello specifico, beta-amiloide 42 (viola), e quindi impedire la loro aggregazione. Il legame avviene tramite i punti di contatto corrispondenti sull'amiloide ("Y" e "K"; a sinistra). Credito:Università di Münster - Bart Jan Ravoo
Un nuovo metodo per legare selettivamente le proteine alle nanoparticelle è stato descritto da un team di ricercatori tedeschi e cinesi guidati dal Prof. Bart Jan Ravoo, un chimico presso l'Università di Münster (Germania). Le nanoparticelle riconoscono automaticamente peptidi specifici, cioè piccole proteine, ed entrare in un legame altamente selettivo con loro. Tra i peptidi modello esaminati dai ricercatori c'erano gli amiloidi. I depositi di amiloidi svolgono un ruolo importante nella malattia di Alzheimer, Per esempio, quindi i ricercatori sperano che il meccanismo che hanno scoperto possa fornire un nuovo approccio al trattamento delle malattie in cui si verificano tali depositi. Lo studio è stato pubblicato nell'ultimo numero di Chimica della natura.
L'interazione tra le molecole proteiche o tra queste e altre biomolecole svolge un ruolo importante in moltissimi processi fisiologici. In tale contesto, il riconoscimento molecolare comporta il legame delle proteine attraverso più punti di contatto su scala nanometrica sulla superficie della proteina. Tipicamente, molti di questi punti sono coinvolti, risultando in un unico, superficie di contatto esatta e complementare. Il meccanismo che queste molecole proteiche si legano è quindi descritto come un "principio chiave e lucchetto". I ricercatori hanno ora descritto un metodo per produrre tali superfici di contatto su nanoparticelle in modo che le proteine selezionate possano essere mirate e legate.
Co-assemblaggio e "eteromultivalenza"
La novità del metodo è che si basa sui principi del co-assemblaggio e della cosiddetta eteromultivalenza. Il co-assemblaggio significa che le nanoparticelle non sono, come è altrimenti usuale, prodotte come risultato di una sintesi chimica complessa e su misura. Anziché, i ricercatori li producono utilizzando un metodo relativamente semplice in cui due componenti di tipo lipidico ("grassi") vengono miscelati in acqua e formano spontaneamente le nanoparticelle necessarie. Queste particelle sono adattative, cioè cambiano la loro struttura interna e quindi raggiungono un legame ottimale con la proteina bersaglio. "Eteromultivalenza" significa che le nanoparticelle formano un numero molto elevato di diversi punti di contatto che, allo stesso tempo, interagiscono con la proteina. Seguendo l'esempio dei processi fisiologici naturali, si verifica così una selettività particolarmente elevata.
"Finora, questo principio di eteromultivalenza, in particolare, è stato appena esaminato in dettaglio o sfruttato, " afferma Bart Jan Ravoo. "Descriviamo un approccio completamente nuovo che consentirà di sviluppare ulteriori leganti proteici sintetici. Questo potrebbe essere considerato per l'uso nella diagnostica o nell'imaging o come potenziali ingredienti attivi nei farmaci." I ricercatori hanno dimostrato che le nanoparticelle si legano con l'amiloide e, di conseguenza, sciogliere gli aggregati di questi peptidi. La presenza di aggregati amiloidi è strettamente connessa con lo sviluppo dell'Alzheimer. Questo è il motivo per cui il nuovo metodo potrebbe fornire un approccio per lo sviluppo di nuovi tipi di trattamento. Non è stato ancora chiarito, però, se gli aggregati amiloidi causano effettivamente l'Alzheimer o lo sono, piuttosto, una conseguenza della malattia. Inoltre, il nuovo metodo per la dissoluzione degli aggregati è stato sperimentato solo in provetta. Sono quindi necessari ulteriori studi per valutare più chiaramente il suo potenziale come approccio al trattamento.
Il metodo
I ricercatori hanno utilizzato anfifilia, ciclodestrina idrosolubile e molecole di calixarene come componenti di co-assemblaggio per i nano punti di contatto. Hanno esaminato il legame delle nanoparticelle risultanti ai peptidi, utilizzando ad esempio la spettroscopia a fluorescenza. Hanno usato la microscopia elettronica per dimostrare il legame con gli amiloidi.