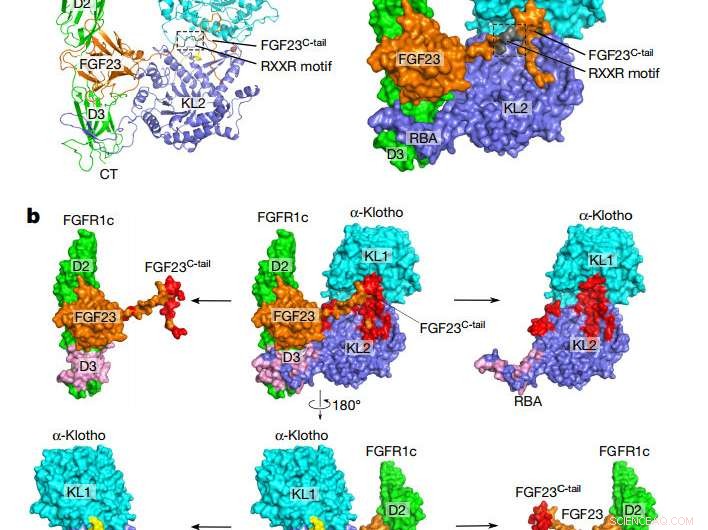
Topologia generale del complesso FGF23-FGFR1cecto-α-klothoecto. un, Rappresentazione del fumetto (a sinistra) e della superficie (a destra) della struttura complessa ternaria. I domini α-klotho KL1 (ciano) e KL2 (blu) sono uniti da un breve linker ricco di prolina (giallo; non visibile nella presentazione superficiale). FGF23 è in arancione con il suo motivo di scollatura proteolitica in grigio. FGFR1c è in verde. TC, C capolinea; NT, N capolinea. B, Interfacce di legame tra α-klothoecto e il complesso FGF23-FGFR1cecto. Il complesso ternario (al centro) è mostrato in due diversi orientamenti legati da una rotazione di 180° lungo l'asse verticale. Le interfacce FGF23–α-klothoecto (rosso) e FGFR1cecto–α-klothoecto (rosa) vengono visualizzate allontanando α-klothoecto e il complesso FGF23–FGFR1cecto l'uno dall'altro. I componenti separati sono mostrati a sinistra ea destra del complesso ternario. Credito: Natura (2018). DOI:10.1038/nature25010
Un nuovo studio rivela la struttura molecolare di una proteina chiamata alfa(α)Klotho, e come aiuta a trasmettere un segnale ormonale che rallenta l'invecchiamento.
Guidato da ricercatori della NYU School of Medicine e pubblicato online il 17 gennaio in Natura , lo studio confuta 20 anni di congetture che αKlotho - dal nome della dea greca che tesse il filo della vita - sia un importante ormone anti-invecchiamento. Invece i risultati attribuiscono questa funzione al fattore di crescita dei fibroblasti 23 (FGF23), e spiega come αKlotho aiuta semplicemente FGF23 a mediare la sua azione anti-invecchiamento.
Studi fin dal 1997 avevano dimostrato che i topi geneticamente manipolati per non avere αKlotho o FGF23 soffrivano di invecchiamento precoce, comprese le malattie cardiovascolari ad esordio precoce, cancro, e declino cognitivo. Fornendo una prima occhiata alla struttura del gruppo di proteine associato che include FGF23, la sua proteina recettore (FGFR), e αKlotho, l'attuale studio ribalta il dogma secondo cui αKlotho agisce da solo come fattore di longevità.
"Mostrando che tutti i modi in cui αKlotho avrebbe dovuto proteggere gli organi derivano invece dalla sua capacità di aiutare il segnale FGF23, abbiamo gettato nuova luce sulla causa sottostante dell'invecchiamento, ", afferma l'autore principale dello studio Moosa Mohammadi, dottorato di ricerca, professore presso il Dipartimento di Biochimica e Farmacologia Molecolare della NYU Langone Health. "I nostri nuovi dati strutturali aprono anche la strada alla progettazione di nuovi agenti che possono incoraggiare o bloccare la segnalazione di FGF23-αKlotho, se necessario".
La struttura risolve il mistero
Per determinare la struttura atomica del gruppo di segnalazione FGF23 delle proteine, Mohammadi e colleghi hanno utilizzato la cristallografia a raggi X. Il team ha prima persuaso l'ormone FGF23, insieme alla sua proteina recettore (FGFR) e αKlotho, per stabilirsi da una soluzione e formare pile di ripetizioni, cristalli ordinati. Hanno quindi esposto i cristalli ai raggi X, e ha utilizzato i modelli riflessi per calcolare la struttura atomica delle proteine.
Il nuovo studio fornisce la prima prova di come FGF23 possa segnalare alle cellule solo formando un complesso con αKlotho, il suo recettore, e un altro partner in eparan solfato. Fatto da cellule ossee, l'ormone FGF23 è noto per viaggiare attraverso il flusso sanguigno verso le cellule di altri organi, dove trasmette il suo messaggio attraccandosi e accendendo il suo recettore. La struttura complessa appena risolta rivela come αKlotho lega FGF23 al suo recettore con sufficiente tenacia per attivarlo.
Lo studio getta inoltre nuova luce su come la malattia renale porti a un ispessimento anomalo del tessuto muscolare cardiaco chiamato ipertrofia. L'ipertrofia cardiaca è una delle principali cause di morte nelle persone con tubuli renali danneggiati, causati (ad esempio) da ipertensione e diabete. Quando i tubuli renali danneggiati non possono più eliminare adeguatamente il fosfato nelle urine, L'FGF23 aumenta nel tentativo di tenere sotto controllo il fosfato nel sangue, in parte controllando i livelli di vitamina D. Un'ipotesi prevalente è stata che livelli molto alti di FGF23 causino ipertrofia nel cuore, ma la teoria è rimasta controversa perché il tessuto cardiaco non ha αKlotho, che deve essere presente se FGF23 deve segnalare.
Studi precedenti avevano dimostrato che la forma più nota di αKlotho è immobile, essendo legato alle membrane superficiali delle cellule nei tubuli renali, la ghiandola paratiroidea, e alcune regioni del cervello. Poi i ricercatori hanno scoperto che una parte della proteina αKlotho che sporge dalle superfici cellulari, il dominio ecto, può essere tagliato e versato nei fluidi corporei circolanti, e quindi potrebbe raggiungere il cuore. Prime prove, però, suggerito che capannone αKlotho era incapace di agire come un co-recettore FGF23. Il nuovo studio integra queste osservazioni mostrando che αKlotho circolante può effettivamente funzionare proprio come la sua forma legata alla membrana per consentire la segnalazione di FGF23.
I ricercatori affermano che i loro risultati lanceranno un'altra corsa allo sviluppo di farmaci nella malattia renale. Mohammadi aveva già dimostrato che un pezzo chiave dell'ormone FGF23 (il suo peptide di coda C-terminale), quando iniettato nei topi, compete con FGF23 intatto per ridurre il suo segnale e prevenire l'ipertrofia cardiaca. Inoltre, il team sta già progettando nuove molecole che alterano il segnale FGF23/shed αKlotho in base alle strutture proteiche appena scoperte.
Lo studio suggerisce anche che una proteina correlata, beta-Klotho, serve come lo stesso tipo di co-recettore per aiutare FGF21, un ormone correlato a FGF23. FGF21 funziona inviando segnali che mantengono in equilibrio la glicemia e gli acidi grassi, con implicazioni per il diabete e l'obesità.