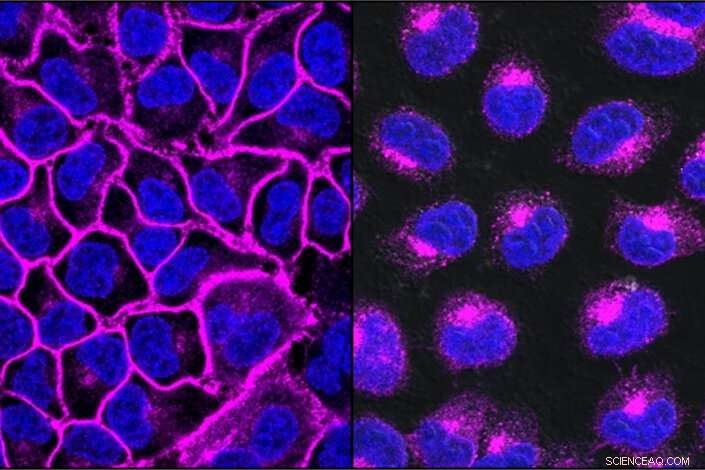
EGFR, una proteina importante nell'aiutare la crescita dei tumori, mostrato qui in viola, decora la superficie cellulare (a sinistra). Dopo il trattamento con un LYTAC mirato all'EGFR, tutta la proteina EGFR viene trasportata nei lisosomi, i compartimenti di degradazione all'interno della cellula (a destra). Credito:Steven Banik
Quando gli scienziati trovano una proteina potenzialmente pericolosa su una cellula, potrebbero immaginare di rimpicciolirsi per diventare piccoli chirurghi, tagliando solo la molecola problematica e lasciando intatte le parti sane della cellula. Mentre mani abili e strumenti affilati non sarebbero mai in grado di asportare una singola proteina dalla superficie di una cellula, un nuovo strumento molecolare potrebbe rendere più facile la chirurgia cellulare, secondo uno studio pubblicato su Natura il 29 luglio.
I chimici di Stanford hanno sviluppato una nuova classe di molecole che trasportano le proteine indesiderate dalla superficie o dall'ambiente circostante di una cellula nel lisosoma, il compartimento cellulare dedicato alla degradazione delle proteine. Queste molecole, chiamate chimere mirate ai lisosomi, o LYTAC, funzionano etichettando selettivamente una proteina con un'etichetta che ne suggella il destino per lo smaltimento dei rifiuti cellulari. Questa degradazione selettiva potrebbe aiutare i ricercatori a studiare e curare malattie come il cancro e l'Alzheimer, le cui cause sono legate alle proteine di superficie.
"È come un bisturi molecolare, " ha detto l'autore principale Steven Banik, un postdoc nel laboratorio di Carolyn Bertozzi, l'Anne T. e Robert M. Bass Professor alla School of Humanities and Sciences. "Questo strumento consente di accelerare la degradazione naturale di una singola proteina tra tutte le diverse proteine che si trovano all'interno o all'esterno di una cellula".
Le proteine sono vitali per molti processi biologici come il metabolismo e la comunicazione intercellulare, ma alcuni possono anche aiutare malattie come il cancro a diffondersi ed eludere la regolazione immunitaria. I metodi tradizionali per ostacolare questi cattivi attori implicano l'uso di farmaci che bloccano il sito attivo della proteina, dove altri componenti cellulari possono attraccare mentre la proteina va a lavorare su di essi, di solito spostando gli atomi. Ma questa strategia di blocco è imperfetta; a volte la tasca di rilegatura è troppo bassa e l'inibitore si stacca troppo rapidamente. Altri tempi, l'attività di una proteina deriva dalle sue proprietà fisiche, come la sua rigidità, e non da alcun sito attivo, quindi bloccare una piccola porzione dell'intera proteina è insufficiente. In questi casi, drenare la cellula della proteina è l'unica opzione.
La degradazione delle proteine come strategia terapeutica è stata particolarmente popolare dallo sviluppo dei PROTAC, o proteolisi mirata alle chimere, 20 anni fa. PROTAC, che cercano ed etichettano le proteine intracellulari per la degradazione, hanno riscontrato successi nei laboratori di ricerca e nei primi studi clinici, ma si basano su un percorso di degradazione inaccessibile a circa il 40% di tutte le proteine che si trovano sopra o all'esterno di una membrana cellulare. Bertozzi e Banik non accettavano che certe proteine - e malattie - fossero fuori portata.
"Il mio laboratorio è sempre stato interessato a ciò che accade sulla superficie cellulare, che contiene tutte queste proteine importanti per la modulazione immunitaria, " disse Bertozzi, che è anche il co-direttore della famiglia Baker di Stanford ChEM-H. "Abbiamo identificato molte proteine di superficie e secrete che riteniamo svolgano ruoli patogeni nel cancro, e i LYTAC potrebbero aiutarci a comprenderli meglio ed esplorarli come bersagli farmacologici".
La chiave per far funzionare lo strumento è il suo design bifunzionale. Un lato di questa molecola può essere personalizzato su misura per legarsi a qualsiasi proteina di interesse. Dall'altro lato c'è una breve sequenza di amminoacidi, o peptide, tempestato di uno zucchero chiamato mannosio-6-fosfato.
Questo zucchero funge da etichetta contabile per la cella. Quando la cellula costruisce proteine che appartengono al lisosoma, aderisce a questi zuccheri per assicurarsi che raggiungano la loro destinazione. "Il mannosio-6-fosfato agisce come un codice postale, " disse Banik. "Questi zuccheri dicono alla cellula, 'Sto portando questa proteina al lisosoma. Per favore mandami lì.'" Ci sono recettori sulla superficie cellulare che interagiscono con questo rivestimento di zucchero, e quando afferrano una molecola di LYTAC e la trascinano nella cellula, le proteine etichettate vengono trascinate con esso.
Nell'attaccare questa etichetta alle proteine, I LYTAC dirottano un meccanismo di spostamento cellulare naturale progettato per scortare le proteine lisosomiali appena sintetizzate nella loro nuova casa. Ma mentre le proteine lisosomiali sono abbastanza resistenti da sopravvivere agli enzimi degradativi che incontrano nel lisosoma, la maggior parte delle proteine non lo sono, quindi quelli contrassegnati dal metodo LYTAC di solito vengono distrutti.
I ricercatori di Stanford mostrano che, nelle cellule, possono prendere di mira e degradare proteine importanti nella malattia di Alzheimer e nel cancro. In accordo con loro, l'estremità proteica del LYTAC può essere qualsiasi cosa che si leghi a una proteina, come un anticorpo o un farmaco esistente, quindi in futuro, molte altre proteine e malattie potrebbero essere attaccate.
"Con strategie di degradazione delle proteine, puoi non solo espandere ciò che è drogabile, ma anche migliorare le terapie che sono già disponibili, " disse Bertozzi. "Ogni cellula ha lisosomi. Ogni cellula ha già un modo per degradare le proteine. Non importa quale sia il tuo obiettivo, se puoi ottenere un LYTAC lì, puoi degradarlo."