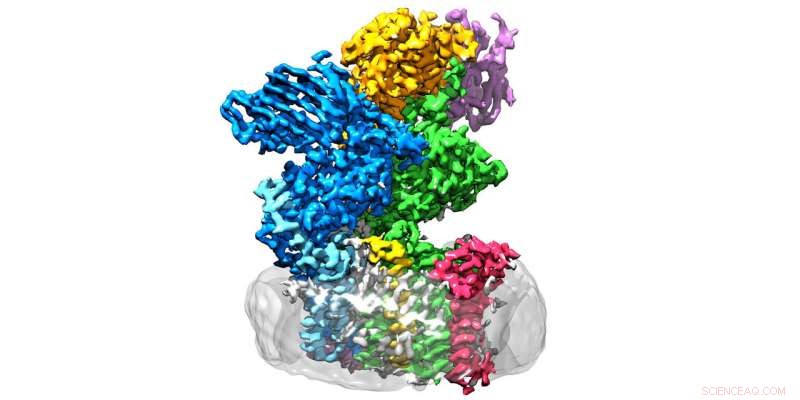
L'enzima oligosaccharyltransferase si trova nella membrana (grigio) ed è costituito da otto subunità. Credito:Julia Kowal / ETH Zurigo
I ricercatori dell'ETH sono riusciti a determinare la struttura 3-D dell'enzima che lega le catene di zucchero alle proteine, una scoperta che hanno recentemente pubblicato sulla rivista Scienza .
Ogni volta che le cellule ricevono segnali, interagire con altre cellule o identificare virus e batteri, il processo coinvolge non solo proteine ma anche catene di zuccheri attaccate alla loro superficie. Oggetto di relativamente poca attenzione fino ad ora, queste strutture differiscono ampiamente per composizione e ramificazione, e sembrano contribuire a garantire che le proteine si ripieghino correttamente e siano in grado di svolgere i loro compiti specifici.
Diverse osservazioni dimostrano l'importanza delle appendici zuccherine:proteine identiche con catene zuccherine diverse hanno funzioni diverse, le cellule malate e sane hanno diverse composizioni di zucchero sulla loro superficie, e i farmaci a cui sono attaccati sono apparentemente tollerati meglio.
Come fa lo zucchero ad arrivare alle proteine?
Conosciuti come glicani, queste sostanze sono attualmente oggetto di un'intensa ricerca. Dopo la genomica e la proteomica, ora c'è anche la glicomica. Il campo di ricerca emergente della glicobiologia si occupa di biosintesi, struttura e le diverse funzioni delle appendici zuccherine. Una domanda chiave è come il diverso insieme di molecole di zucchero raggiunga le proteine in primo luogo.

Immagini al microscopio crioelettronico dell'enzima. Credito:Rebekka Wild / ETH Zurigo
I ricercatori dell'ETH nei gruppi guidati da Kaspar Locher dell'Istituto di Biologia Molecolare e Biofisica e Markus Aebi dell'Istituto di Microbiologia hanno compiuto un deciso passo avanti in questo campo:hanno determinato la struttura tridimensionale dell'oligosaccariltransferasi (OST) in lievito. "Questo è l'enzima che collega le proteine agli alberi di zucchero, " spiega Rebekka Wild, uno dei tre principali autori del rapporto in Scienza in cui i ricercatori dell'ETH presentano i loro risultati.
Determinare la struttura di OST non è stato facile:per cominciare, Jilliane Eyring, il terzo autore principale del rapporto, modificato le cellule di lievito in modo che l'enzima potesse essere mirato e purificato. Wild dovette prima estrarre l'enzima, che è incorporato in una membrana nella cellula, da grandi quantità di queste cellule di lievito per poi purificarlo con un laborioso procedimento. "Nove litri di lievito hanno prodotto circa 0,2 milligrammi di enzima, " dice. Le molecole OST sono state applicate a una piccola griglia, congelato come individuo, particelle separate e ripreso utilizzando un microscopio crioelettronico ad alta risoluzione.
Ciò ha dato origine a migliaia di immagini che mostrano il complesso enzimatico da ogni possibile angolo di visione. Da queste immagini, Julia Kowal, il secondo autore principale, generato la struttura tridimensionale di OST. Ci sono volute sei settimane per eseguire i calcoli sul cluster di computer. Il risultato è stata una mappa della densità elettronica che mostra l'enzima come una "nube elettronica".
"Abbiamo colto un momento fortunato, " spiega Wild. Sono stati in grado di beneficiare della "rivoluzione della risoluzione" attualmente in corso nella microscopia crioelettronica e di utilizzare un dispositivo all'avanguardia con risoluzione atomica. Lo sviluppo di questa tecnologia è stato insignito del premio Nobel in chimica nel 2017.
Per interpretare i dati della microscopia elettronica, Wild ha dovuto adattare la sequenza di amminoacidi di OST "manualmente" nelle piccole nuvole della mappa tridimensionale. Così, il ricercatore è stato in grado di rappresentare la struttura 3D di OST in tutti i dettagli, una svolta che è stata accolta con gioia dai ricercatori dopo che è stata pubblicata online.
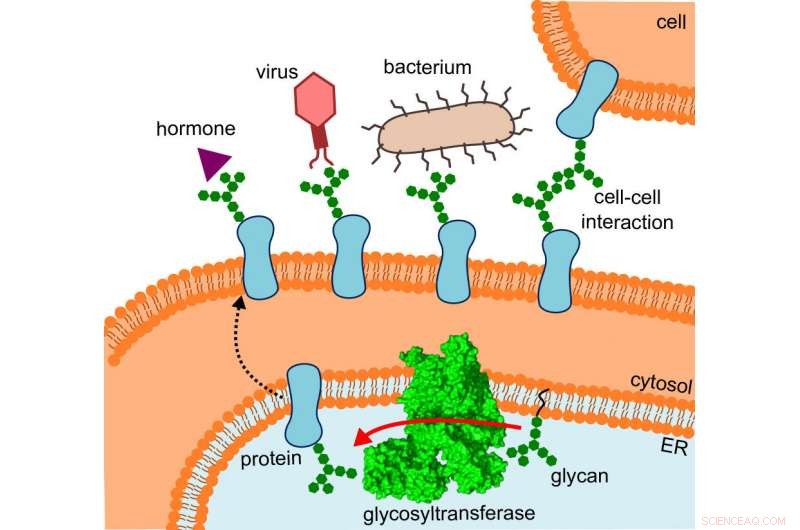
Il diagramma mostra dove si trova la glicosiltransferasi, il percorso che le proteine alterate prendono e le interazioni che subiscono. Credito:R. Wild / ETH Zurigo
OST è un complesso proteico di membrana composto da otto subunità, che identificano, Per esempio, i substrati zuccherini o proteici o stabilizzare l'unità catalitica. Quest'ultima è la subunità dell'enzima che ospita il centro attivo, dove proteine e zuccheri si uniscono e si fondono. "Ci aspettavamo che l'unità catalitica si trovasse nel mezzo dell'enzima, " Wild spiega. "Sorprendentemente, però, è all'esterno e la forma ricorda una bocca spalancata."
Ciò che inizialmente aveva confuso i ricercatori ha improvvisamente avuto un senso, in quanto hanno adattato la struttura al luogo in cui OST opera effettivamente:in particolare, l'enzima è incorporato in vivo nella membrana del reticolo endoplasmatico (ER). Questa è la parte della cellula in cui vengono prodotte le proteine, piegato, monitorato e modificato.
Qui, il vicino diretto dell'OST è una proteina tunnel – questo era già noto. Questo incanala le proteine nascenti all'interno del reticolo endoplasmatico e poi direttamente nella bocca spalancata dell'OST, dove ricevono i loro piccoli alberi di zucchero.
"Il lievito OST è un buon modello per i processi negli esseri umani, " spiega Wild. I ricercatori traggono questa conclusione dal fatto che il centro attivo del lievito OST, dove le proteine sono dotate di zuccheri, assomiglia molto all'area corrispondente nei batteri. "Ciò significa che il centro attivo è appena cambiato nel corso dell'evoluzione, " spiega il ricercatore, "il che significa che ci sono buone probabilità che funzioni ancora in modo molto simile nei mammiferi, e quindi anche negli esseri umani».