
Una dimostrazione della chiralità molecolare utilizzando modelli atomici 3D in laboratorio. Credito:J. Waser/EPFL
Molte molecole chimiche possono esistere in natura insieme alle loro controparti specchio; come mani, due composti possono essere costituiti dagli stessi atomi nella stessa struttura complessiva ma con orientamenti opposti, cioè mancino e destrorso. Questo fenomeno di simmetria è chiamato "chiralità", e può dare alle controparti speculari ("enantiomeri") proprietà chimiche completamente diverse. Un famoso e tragico esempio di chiralità è il talidomide, che era originariamente venduto come una miscela di entrambi gli enantiomeri. Il problema era che uno era un sedativo innocuo e l'altro altamente tossico per i feti, con conseguenti malformazioni congenite disturbanti.
Quindi oggi è diventato imperativo sintetizzare composti con quella che è nota come elevata "purezza ottica", che è una misura della purezza chirale:il grado in cui un campione contiene un enantiomero in quantità maggiori dell'altro. Ma poiché gli enantiomeri hanno differenze strutturali molto piccole e stabilità identica, sintetizzare l'uno sull'altro è un compito molto impegnativo.
Un modo per farlo è ciò che i chimici chiamano "desimmetrizzazione" di un composto non chirale che è simile alla molecola bersaglio. Ciò comporta la modifica di una molecola in modo che perda gli elementi di simmetria che le hanno impedito di essere chirale.
I ricercatori del laboratorio di catalisi e sintesi organica di Jérôme Waser presso l'EPFL hanno ora sviluppato una nuova strategia di desimmetrizzazione per accedere a blocchi di costruzione chirali contenenti sottostrutture di urea. I derivati dell'urea sono componenti importanti di biomolecole come la biotina (vitamina B7) o prodotti naturali bioattivi, come l'agelastatina antitumorale A.
I ricercatori hanno apportato due innovazioni cruciali. Primo, hanno progettato un precursore del ciclopropano (anello di carbonio a tre membri) non chirale. Questa molecola offre una maggiore reattività ed è ideale per reazioni in condizioni blande.
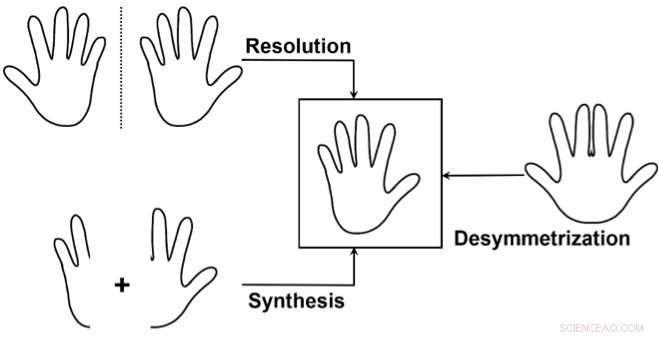
I tre approcci principali per accedere selettivamente a un enantiomero:1) Separare una miscela dei due enantiomeri (risoluzione), sprecare uno degli enantiomeri. 2) Sintetizzare selettivamente solo uno dei due enantiomeri. 3) Utilizzare una "desimmetrizzazione" di un composto non chirale simile al bersaglio. Questo è usato meno spesso, ma è particolarmente elegante in quanto può rivelare la chiralità da un precursore già relativamente complesso rompendo la simmetria in una sola semplice trasformazione. Credito:J. Waser/EPFL
Secondo, i ricercatori hanno progettato un nuovo catalizzatore di rame che può formare un enantiomero del prodotto desiderato con un'elevata selettività. Il centro del rame si lega e attiva il precursore del ciclopropano, provocando la rottura dei suoi legami. Il precursore viene poi attaccato da un indolo, una molecola molto importante come elemento strutturale di composti bioattivi. Di conseguenza, il precursore perde la sua simmetria - e quindi diventa chirale - e può essere usato per produrre selettivamente l'enantiomero desiderato.
Il lavoro è una svolta importante, poiché la desimmetrizzazione non è mai stata utilizzata per accedere alle uree chirali dai ciclopropani prima d'ora. "Ora è possibile accedere facilmente a nuovi elementi costitutivi come enantiomeri puri, e può essere testato per la bioattività o utilizzato per sintetizzare molecole chirali più complesse, " dice Jérôme Waser. "Inoltre, il nuovo catalizzatore che abbiamo progettato sarà sicuramente utile per altre applicazioni in chimica di sintesi".
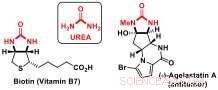
Urea:importanti elementi costitutivi delle molecole bioattive. Credito:J. Waser/EPFL