
Rappresentazione artistica di una membrana con proteine incorporate:i ricercatori dell'ETH di Zurigo hanno sviluppato un metodo che darà impulso alla delucidazione strutturale di tali molecole. Credito:www.colourbox.com
I ricercatori dell'ETH hanno sviluppato un nuovo metodo per cristallizzare grandi proteine di membrana al fine di determinarne la struttura. Ciò andrà a vantaggio della ricerca biologica e dell'industria farmaceutica.
Le proteine incorporate nella membrana sono una parte essenziale delle cellule e di qualsiasi forma di vita. Non solo esistono in molte varietà diverse, ma anche svolgere una vasta gamma di funzioni, che vanno dalla comunicazione intracellulare e il trasporto di sostanze dentro o fuori la cellula alla mediazione della risposta immunitaria. Le proteine di membrana sono considerate importanti strutture target terapeutiche e diagnostiche. Se si conoscono la loro struttura e le loro funzioni, i ricercatori farmaceutici possono sviluppare sostanze attive che influenzano queste funzioni in modo mirato.
Fino ad ora, però, chiarire la struttura delle proteine di membrana è stato molto difficile poiché prima richiede ai ricercatori di isolare un gran numero di queste molecole e formare cristalli da esse. Qui sta la difficoltà:le proteine di membrana sono insolubili in acqua e spesso troppo grandi ed eterogenee per essere cristallizzate con i metodi standard.
Ora, il gruppo guidato da Raffaele Mezzenga, Professore di Food and Soft Materials all'ETH di Zurigo, sta lavorando per eliminare questa restrizione. In una pubblicazione sulla rivista Comunicazioni sulla natura , il gruppo presenta un metodo generale, che può essere utilizzato per cristallizzare proteine di membrana di qualsiasi tipo o dimensione.
Miscela di acqua e lipidi come camera di reazione
Le basi per il nuovo metodo sono state poste negli anni '90 con il metodo chiamato "in meso cristallizzazione":le proteine vengono isolate e concentrate utilizzando miscele acqua-lipidi stabili note come mesofasi lipidiche. In mesofasi di questo tipo, un processo di autoassemblaggio porta ad una rete tridimensionale di canali d'acqua piegati le cui pareti sono costituite da lipidi, come in una biomembrana. Questi canali d'acqua hanno tipicamente un diametro di 3-4 nanometri, e il motivo cubico di base della rete viene ripetuto a intervalli regolari.
In canali di questo tipo, le proteine di membrana si incastrano nelle pareti utilizzando la parte idrofoba che altrimenti si trova nella membrana cellulare. Il resto della proteina finisce all'interno del canale d'acqua, e le proteine, una volta correttamente ricostituito, può quindi iniziare a cristallizzare. È proprio perché i canali offrono così poco spazio che in passato, solo le piccole proteine di membrana potevano essere cristallizzate:le proteine grandi venivano frantumate e non formavano cristalli.
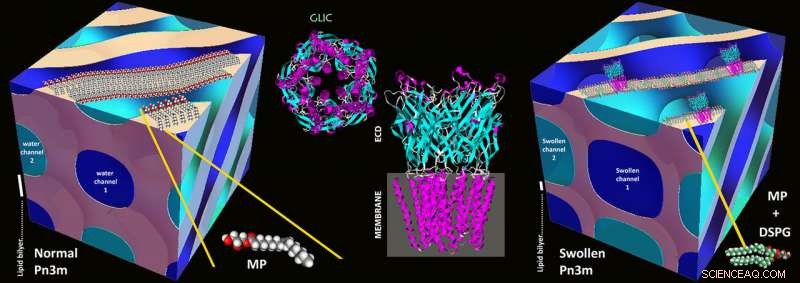
Illustrazioni schematiche di una normale mesofase cubica Pn3m composta da MP:acqua (a sinistra), Struttura della proteina GLIC (al centro), e nella meso cristallizzazione della proteina GLIC in una mesofase cubica Pn3m altamente rigonfia composta da DSPG:MP:acqua (a destra). Credito:Zabara A et al, Comm. Naz., 2018
Canali espansi utilizzando lipidi carichi
I ricercatori dell'ETH hanno ora usato un trucco per espandere i canali:hanno mescolato una piccola percentuale di lipidi caricati elettricamente con i lipidi. Questi si respingono e quindi gonfiano i canali, aumentando il loro diametro a 20 nanometri. Sebbene i primi tentativi di dilatare elettrostaticamente i canali dell'acqua nelle mesofasi lipidiche risalgano all'inizio degli anni 2000 e siano continuati costantemente fino a tempi recenti, questa è la prima evoluzione dimostrata di questa strategia in una metodologia di significato generale.
Grazie a queste mesofasi lipidiche gonfie, infatti, Mezzenga e i suoi colleghi sono riusciti a cristallizzare grandi proteine di membrana e quindi a chiarirne la struttura.
I ricercatori dell'ETH si sono esercitati sulla proteina di membrana chiamata GLIC (Gloeobacter ligand-gated ion channel), che deriva dai batteri. GLIC ha diverse grandi subunità che si trovano all'esterno della membrana batterica nella parte esterna della cellula. Nel passato, è stato utilizzato un metodo diverso per cristallizzare questo complesso poiché questi domini erano troppo grandi. "La nostra procedura non solo ha migliorato la cristallizzazione, ma ha anche prodotto cristalli estremamente compatti appartenenti a un nuovo gruppo cristallografico per questa proteina, " dice Mezzenga. Inoltre, i ricercatori sono stati in grado di cristallizzare per la prima volta questa proteina canale nella sua configurazione chiusa. Fino ad ora, i ricercatori sono stati in grado di cristallizzare il complesso solo nel suo stato aperto utilizzando un metodo diverso.
Incremento previsto per delucidazione strutturale
Il nuovo metodo "generalizzato in meso" potrebbe essere di grande interesse in particolare per i biologi strutturali, che fino ad ora hanno lottato per chiarire la struttura delle grandi proteine di membrana. "Questo strumento darà nuovo impulso alla delucidazione strutturale, poiché apre proteine che prima erano fuori portata, "dice Mezzenga.
Attualmente, gli scienziati conoscono l'esatta struttura di sole 360 piccole proteine di membrana, o circa un settimo di tutte le proteine di membrana. La struttura delle molte proteine di membrana rimanenti è sconosciuta.
Secondo Mezzenga, la ricerca può anche essere di beneficio per l'industria farmaceutica. "La capacità di determinare la struttura è di fondamentale importanza per lo sviluppo di nuovi farmaci, " dice. "Questo metodo semplificherà notevolmente le cose e darà nuovo impulso al campo".