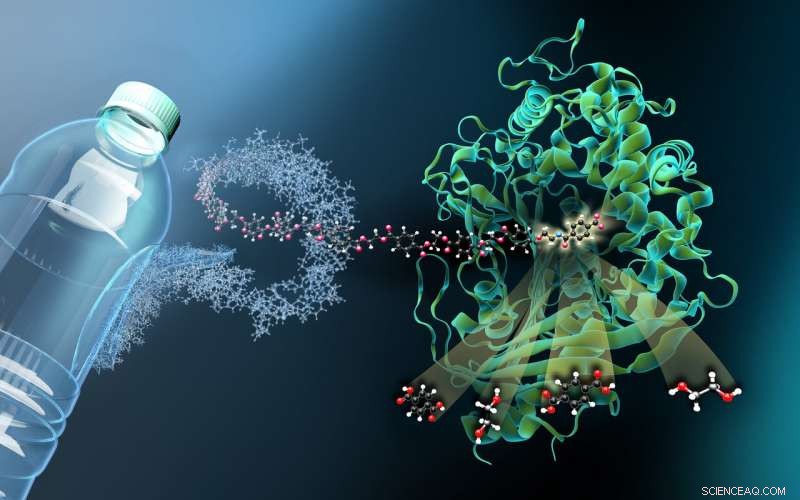
L'immagine mostra la struttura della MHETasi legata a un ligando derivato da PET non idrolizzabile (MHETA). Fibre polimeriche simboliche collegano MHETA a una tipica bottiglia in PET, indicando il grande potenziale delle varianti potenziate di PETasi e MHETasi nel riciclaggio enzimatico della plastica. A questo proposito, i nostri dati strutturali hanno facilitato la generazione di varianti MHETase iniziali con attività migliorata e specificità di substrato estesa. I nostri risultati rappresentano quindi un passo importante sulla strada per un sistema PETase/MHETase migliorato in cui il riciclaggio del PET è disaccoppiato dalla sua dipendenza dal petrolio greggio in modo sostenibile e a risparmio energetico. Attestazione:Martin Künsting/HZB
Un team di ricerca dell'Università di Greifswald e Helmholtz-Zentrum-Berlin (HZB) ha risolto la struttura molecolare dell'enzima MHETase a BESSY II. MHETase è stato scoperto nei batteri, e insieme a un secondo enzima, PETasi, è in grado di scomporre il PET di plastica ampiamente utilizzato nei suoi elementi costitutivi di base. Questa struttura 3D ha già permesso ai ricercatori di produrre una variante MHETase con attività ottimizzata per poterla utilizzare, insieme a PETase, per un riciclo sostenibile del PET.
Le materie plastiche sono estremamente versatili e quasi eternamente durevoli. Ma anche questo è un problema, perché dopo solo circa 100 anni di produzione di plastica, le particelle di plastica si trovano ora ovunque:nelle acque sotterranee, negli oceani, nell'aria, e nella catena alimentare. Ogni anno vengono prodotte circa 50 milioni di tonnellate del PET polimerico di importanza industriale. Solo una piccola frazione della plastica viene attualmente riciclata tramite processi costosi e che consumano energia che producono prodotti declassati o dipendono a loro volta dall'aggiunta di petrolio greggio "fresco".
Nel 2016, un gruppo di ricercatori giapponesi ha scoperto un batterio che cresce sul PET e si nutre parzialmente di esso. Hanno scoperto che il batterio possiede due enzimi speciali, PETasi e MHETasi, che digeriscono i polimeri plastici PET. PETase scompone la plastica in blocchi di PET più piccoli, principalmente MHET, e MHETase lo divide nei due elementi fondamentali precursori del PET, acido tereftalico e glicole etilenico. Entrambi i componenti sono preziosi per sintetizzare nuovo PET senza l'aggiunta di petrolio greggio per un ciclo di produzione e recupero sostenibile chiuso.
Ad aprile 2018, la struttura della PETase è stata infine risolta indipendentemente da diversi gruppi di ricerca. Anche la Diamond Light Source è stata coinvolta negli esperimenti. Però, PETase è solo una parte della soluzione. È altrettanto importante caratterizzare la struttura del secondo enzima, MHETasi.
"La MHETasi è considerevolmente più grande della PETasi e persino più complessa. Una singola molecola di MHETasi è costituita da 600 amminoacidi, o circa 4000 atomi. MHETase ha una superficie che è circa il doppio della superficie della PETase e ha quindi un potenziale considerevolmente maggiore di ottimizzazione verso la decomposizione del PET, " spiega il biochimico e biologo strutturale Dr. Gert Weber di Helmholtz-Zentrum Berlin e Freie Universität Berlin.
Durante una cattedra ad interim presso l'Università di Greifswald, Weber ha contattato il biotecnologo Prof. Uwe Bornscheuer presso l'Istituto di Biochimica, che era già coinvolto con gli enzimi che degradano la plastica. Insieme, hanno sviluppato l'idea di risolvere la struttura della MHETasi e quindi di utilizzare questa intuizione per ottimizzare l'enzima per applicazioni nel riciclaggio del PET. Per fare questo, dovevano prima estrarre l'enzima dalle cellule batteriche e purificarlo. All'interno di questa collaborazione, i team sono riusciti a ottenere la complessa architettura tridimensionale di MHETase a BESSY II, la sorgente di sincrotrone all'HZB di Berlino.
"Per vedere come MHETase si lega al PET e lo decompone, hai bisogno di un frammento di plastica che si leghi alla MHETase ma non venga scisso da essa, " spiega Weber. Un membro del precedente gruppo di ricerca di Weber a Greifswald, Dottor Gottfried Palm, tagliare una bottiglia in PET, ha decomposto chimicamente il polimero PET e ne ha sintetizzato un piccolo frammento chimico che si lega alla MHETasi ma non può più essere scisso da essa. Da questo MHETase "bloccato", minuscoli cristalli sono stati coltivati per indagini strutturali presso l'HZB. "Le indagini strutturali ci hanno permesso di osservare virtualmente MHETase "al lavoro" e sviluppare strategie su come ottimizzare questo enzima, " spiega Weber.
"Grazie al formato del gruppo di ricerca congiunto, abbiamo i mezzi per offrire l'accesso al tempo del fascio sulle molto richieste linee di luce BESSY II MX per misurazioni molto rapidamente in qualsiasi momento, "dice il dottor Manfred Weiss, who is responsible for the BESSY II MX beamlines. The three-dimensional architecture of MHETase actually displays some special features:enzymes such as MHETase bind to their target molecule first before a chemical reaction occurs. For breakdown of a molecule you need a tailor-made enzyme:"We can now exactly localise where the MHET molecule docks to MHETase and how MHET is then split into its two building blocks terephthalic acid and ethylene glycol, " says Weber.
Però, neither PETase nor MHETase are particularly efficient. "Plastics have only been around on this scale for a few decades—even bacteria with their rapid successions of generations and rapid adaptability have not managed to develop a perfect solution through the evolutionary process of trial and error over such a short time, " explains Weber. "Thanks to the clarification of the structure of this very important enzyme, we have now also been able to plan, produce and biochemically characterise variants that show significantly higher activity than natural MHETase and are even active against another intermediate product of PET degradation, BHET, " adds Uwe Bornscheuer.
In futuro, Uwe Bornscheuer will work on systematically optimising the enzymes PETase and MHETase for their task—the decomposition of PET. Gert Weber plans to supplement these studies with further work on biological structures in order to systematically develop plastic-digesting enzymes for environmental applications. Access to the measuring stations and the IT infrastructure of HZB is indispensable for this.
Producing these kinds of enzymes in closed biotechnological cycles, Per esempio, could be a way to really break down PET plastics and other polymers into their basic building blocks. This would also be the key to ideal recycling and a long-term solution to the plastic waste problem:production of plastic would be a closed cycle and no longer dependent on crude oil.
Lo studio è pubblicato su Comunicazioni sulla natura .