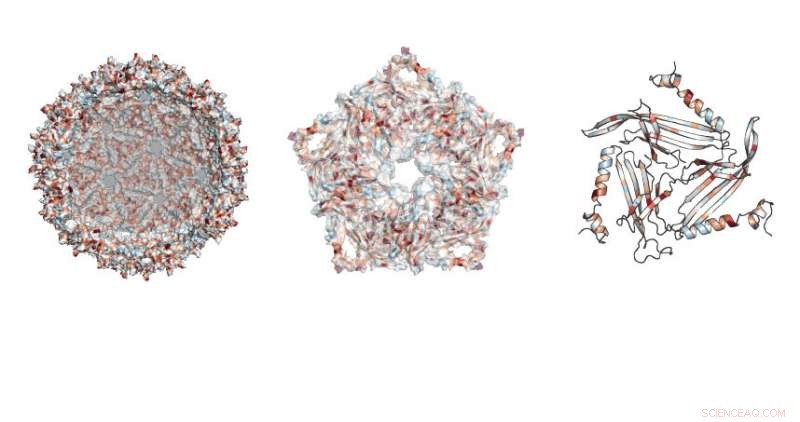
I ricercatori hanno studiato dove erano consentite le mutazioni nella struttura simile a un pallone da calcio realizzata dall'impalcatura MS2. Credito:Northwestern University
I ricercatori della Northwestern Engineering hanno sviluppato un nuovo modo per manipolare un guscio di virus che si autoassembla dalle proteine e promette come vettore per il rilevamento delle malattie, consegna farmaci, e vaccinazioni.
I virus hanno gusci costruiti per sopravvivere in condizioni difficili, proteggendo il loro carico finché non trovano una cellula da infettare. Il guscio può essere usato per sempre, però, perché quella stabilità lo rende adatto a proteggere il carico più utile, come farmaci, che possono essere consegnati a cellule specificamente mirate.
La ricerca si è concentrata su una proteina utilizzata da un virus batterico chiamato batteriofago MS2. Questa proteina può autoassemblarsi, creando un'innocua impalcatura fuori dal guscio virale, disse Danielle Tullman-Ercek, professore associato di ingegneria chimica e biologica presso la McCormick School of Engineering.
"In biologia, ogni cosa ha il suo posto. La biologia è fantastica così, tranne per il fatto che non conosciamo le regole, " Ha detto Tullman-Ercek. "La nostra scoperta è stata il metodo per determinare quelle regole di progettazione".
Lo studio, fatto in collaborazione con il professore di chimica Matthew Francis e i suoi colleghi dell'Università della California a Berkeley, ci sono voluti più di due anni. I risultati sono stati pubblicati l'11 aprile sulla rivista Comunicazioni sulla natura .
Il lavoro ha permesso ai ricercatori di esaminare quali specifiche mutazioni proteiche hanno rotto l'impalcatura del virus o modificato le proprietà della struttura. Fare quello, il team ha sviluppato una nuova tecnica chiamata SyMAPS (Systematic Mutation and Assembled Particle Selection), che ha separato le proteine dell'impalcatura mutate rimaste intatte da quelle che si sono rotte durante la mutazione.
In totale, il team ne ha testati quasi 2, 600 versioni della proteina, che costituisce il guscio chiuso, impalcatura simile a un pallone da calcio.
"La proteina dell'impalcatura MS2 ha 129 posizioni in cui possiamo effettuare sostituzioni, sostituendo l'amminoacido esistente in quella posizione con tutti gli altri amminoacidi, " ha detto Emily Hartman, un dottorando del quarto anno in chimica alla UC Berkeley e autore principale della carta. "Scambiando tutti i 20 amminoacidi naturali, uno alla volta, in ogni posizione della proteina, finiamo per testare 20 variabili in 129 posizioni."
Il team ritiene che la comprensione di come le mutazioni modificano l'impalcatura fornisca importanti informazioni su come queste proteine virali riproposte potrebbero essere utilizzate in medicina.
"L'impalcatura che desideri per la consegna dei farmaci potrebbe essere diversa da quella che vorresti per un vaccino, " Ha detto Tullman-Ercek. "Potremmo voler cambiare le proprietà della carica sulla superficie per ottenere un targeting migliore o aggiungere qualcosa all'interno della struttura, come caricarlo con un sensore o un registratore diagnostico."
Ad esempio, una struttura che cade a pezzi in un ambiente specifico potrebbe aiutare la somministrazione mirata di farmaci, come la chemioterapia.
"Una delle cose che abbiamo fatto nello studio è stata la ricerca di mutanti sensibili all'acido, "Ha detto Hartman. "Il flusso sanguigno non è acido, ma una volta dentro una cellula cancerosa, è molto più acido. Se l'impalcatura cade a pezzi in ambienti acidi, rilascerebbe più facilmente il farmaco all'interno di una cellula cancerosa".
È stata trovata una struttura meno tollerante alle condizioni acide, e il team continuerà a lavorare in questo settore.
Inoltre, lo studio offre informazioni su ciò che potrebbe sorgere naturalmente in un virus mutante, come l'influenza. "Questo potrebbe darci un'idea di quali posti nel virus potrebbero avere un più alto tasso di mutazione. Tali informazioni potrebbero essere utilizzate dagli scienziati per sviluppare nuovi vaccini, " Disse Tullman-Ercek.
Il team e i loro colleghi di entrambe le università utilizzeranno il lavoro come base per applicazioni specifiche per l'impalcatura virale, lei disse.
"Questo documento è davvero un primo passo in una serie più ampia di storie, " Hartman ha detto. "C'è molto lavoro in corso in questa collaborazione tra le università. Sono entusiasta di vedere dove va.
Lo studio si basa sul lavoro precedente di Tullman-Ercek, che ha scoperto che una singola mutazione amminoacidica nella stessa impalcatura del batteriofago MS2 ha cambiato drasticamente le sue dimensioni.
Tullman-Ercek è membro di facoltà all'interno del Centro di biologia sintetica della Northwestern. Il centro di due anni riunisce scienziati di ingegneria, medicinale, fisica, e informatica interessati a manipolare la biologia per aiutare la società. Gran parte della biologia sintetica si concentra sul cambiamento di una cellula modificando il suo DNA, creazione di nuovi prodotti specializzati.