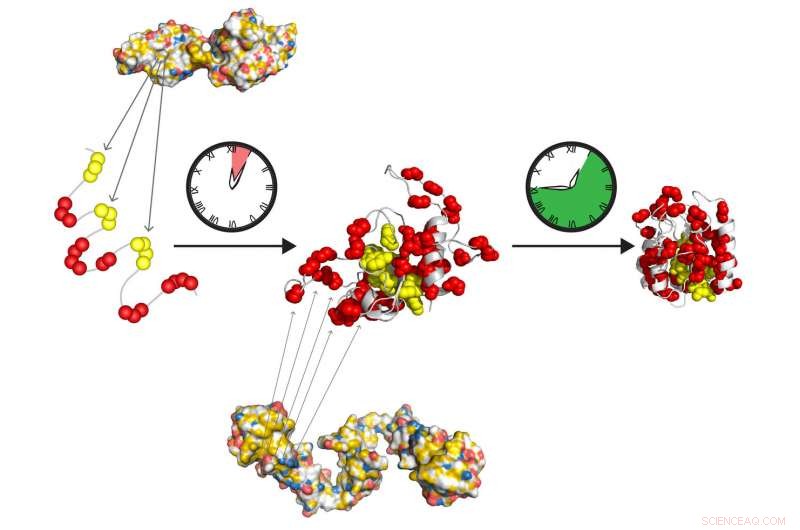
Gli chaperon molecolari Hsp70 e Hsp90 formano un team di relè ad azione rapida per preparare le proteine a ripiegarsi da sole nel loro stato attivo. Hsp70 riconosce brevi tratti idrofobici (giallo), esposto nella proteina spiegata. Hsp90 agisce a valle di Hsp70 e facilita la formazione della piega intermedia, che lentamente si trasforma nello stato nativo, libero da ulteriori azioni di accompagnamento. Credito:Tania Morán Luengo e Stefan Rüdiger, Università di Utrecht
Le proteine cellulari sono prodotte come lunghe catene di amminoacidi che devono ripiegarsi con precisione nella loro forma finale. I protagonisti di questo processo di piegatura sono i cosiddetti chaperon molecolari, aiutanti proteici che assicurano che questo processo abbia successo. Ricercatori dell'Università di Utrecht, in stretta collaborazione con i colleghi dell'Università di Heidelberg, hanno finalmente scoperto come le due più importanti famiglie di accompagnatori, Hsp70 e Hsp90, cooperare in questo processo di piegatura. Sorprendentemente, si scopre che non aiutano attivamente nella piegatura, come gli scienziati avevano a lungo ipotizzato. Anziché, preparano semplicemente le proteine per spontanei, piegatura produttiva. Questa svolta nella comprensione del funzionamento della cascata Hsp70-Hsp90 sarà pubblicata in Cellula molecolare il 3 maggio.
Le proteine piegate in modo errato possono causare malattie gravi come la fibrosi cistica e molte malattie neurodegenerative come l'Alzheimer. Gli scienziati sanno da tempo che Hsp70 e Hsp90 svolgono un ruolo chiave in questo processo di piegatura, e che Hsp90 agisce a valle di Hsp70. Però, l'effettivo meccanismo con cui ripiegano una proteina è rimasto enigmatico.
dottorato di ricerca La candidata Tania Morán Luengo dell'Università di Utrecht ha recentemente dimostrato che lo chaperone Hsp70 si lega alla giovane proteina, proteggendolo e allo stesso tempo impedendogli di piegarsi. Quindi Hsp90 rompe il blocco Hsp70, che consente alla proteina di continuare a ripiegarsi nello stato corretto da sola. Questa scoperta ha segnato la fine sorprendente della credenza di vecchia data secondo cui gli accompagnatori ripiegano le proteine.
Il leader della ricerca, il dott. Stefan Rüdiger dell'Università di Utrecht, ha avuto un assaggio di questa nuova idea mentre si preparava a tenere un corso sull'argomento. Hsp70 si lega agli amminoacidi idrofobici, proteggendoli dall'attaccarsi tra loro fino a quando non si nascondono all'interno della struttura proteica finale. Si rese conto che il modo in cui Hsp70 si lega ai suoi substrati quindi non poteva contribuire al ripiegamento delle proteine, ma piuttosto lo inibisce.
I ricercatori hanno quindi deciso di analizzare il processo di piegatura, osservando che concentrazioni di Hsp70 nell'intervallo di quelle presenti nelle nostre cellule inibiscono il ripiegamento proteico. "Questo ha dedotto che Hsp70 non è un promotore, ma in realtà un efficace inibitore del processo di piegatura, " Spiega Rüdiger. Il suo gruppo ha collaborato con il laboratorio del Prof. Matthias Mayer all'Università di Heidelberg per testare sperimentalmente questa ipotesi. Hanno dimostrato che la presenza di Hsp90 a questo punto è fondamentale per il processo di ripiegamento. Hsp90 consente alla proteina di rompersi fuori dallo stallo di Hsp70 per piegarsi nella sua giusta forma da solo.
Molecular Cell sceglie un'illustrazione di questa ricerca per la sua copertina. L'opera d'arte è stata realizzata dal capo della ricerca Stefan Rüdiger (acrilico su tela). Rappresenta che gli chaperoni Hsp70 e Hsp90 conservati formano una cascata attiva solo nel primo, minuti roventi del processo di piegatura. Il successivo passaggio attraverso il sentiero allo stato nativo è lungo e lento e privo di interferenze da parte degli accompagnatori. Credito:Cellula molecolare / Stefan Rüdiger, Università di Utrecht
"Questo meccanismo stop-start si conserva dai batteri all'uomo, " Rüdiger dice. "Molte malattie dipendono dalla forma attiva finale delle proteine. Così, i ricercatori che lavorano su terapie che mirano al processo di piegatura sanno finalmente cosa cercare".