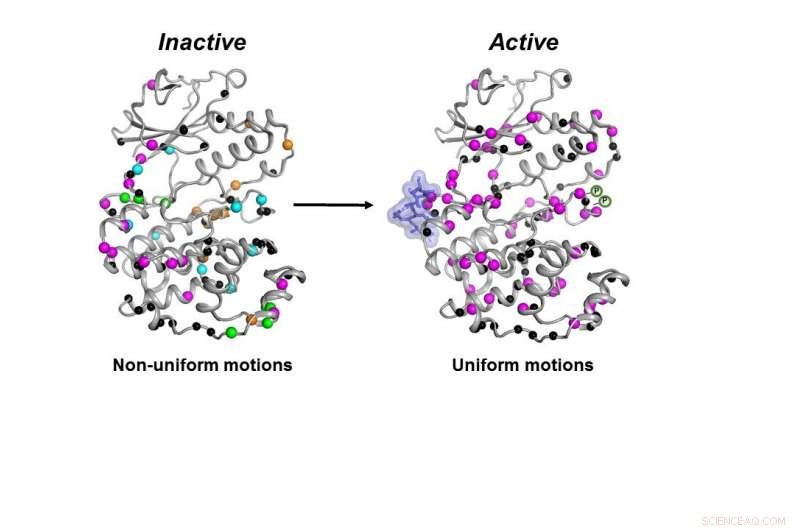
La forma inattiva (a sinistra) dell'enzima MAPK p38 si muove in modo non coordinato. Una volta che le molecole necessarie (macchia blu e simboli P) si legano, l'enzima si attiva (a destra) muovendosi in modo coordinato per svolgere il suo lavoro all'interno di una cellula. Credito:Senthil Ganesan, Dipartimento di Chimica e Biochimica dell'Università dell'Arizona.
Rivelare tutti i passaggi necessari per attivare un enzima chiamato protein chinasi può identificare nuovi modi per colpire il cancro, secondo una nuova ricerca condotta dall'Università dell'Arizona.
Non solo la chinasi deve avere tutte le parti necessarie in posizione, l'enzima deve muoversi nel modo corretto e alla velocità corretta per funzionare correttamente in una cellula, i ricercatori hanno scoperto.
Primo autore Senthil Kumar Ganesan, un professore assistente di ricerca UA di chimica e biochimica, dette chinasi sono interruttori che attivano o disattivano determinati processi cellulari. Se le chinasi di una cellula smettessero di funzionare, la cellula morirebbe.
Il team guidato da UA è il primo gruppo a capire il percorso completo per l'attivazione di una proteina chinasi, ha affermato l'autore senior Wolfgang Peti, che detiene la cattedra di chimica Weed Endowed di Homer C. e Emily Davis presso l'Università dell'Arizona.
"Le chinasi sono uno dei principali bersagli dei farmaci antitumorali, " disse Peti, che è anche membro dell'UA BIO5 Institute e dell'UA Cancer Center. "Se sai come funziona una chinasi, puoi sicuramente progettare meglio le tue droghe contro di esso."
È probabile che lo sviluppo di un farmaco che tragga vantaggio da questa nuova scoperta richiederà almeno 10 anni, Egli ha detto.
I farmaci antitumorali già in uso che prendono di mira le chinasi sono dasatinib e imatinib per la leucemia mieloide cronica e afatinib per il carcinoma polmonare non a piccole cellule, ha detto Ganesan.
Per osservare una chinasi chiamata protein chinasi attivata da mitogeni (MAPK) p38 in azione, i ricercatori hanno utilizzato la spettroscopia di risonanza magnetica nucleare (NMR).
Tutte le molecole necessarie dovevano legarsi a p38 affinché l'enzima diventasse attivo. Solo allora l'enzima potrebbe muoversi correttamente per svolgere il suo lavoro nella cellula, i ricercatori hanno scoperto.
"Abbiamo capito come si muove per svolgere il suo lavoro e qual è il contributo della velocità di movimento al suo lavoro, " disse Peti.
La scoperta suggerisce che una nuova strada per lo sviluppo di farmaci antitumorali potrebbe essere la creazione di farmaci che interferiscono con il movimento di p38, Egli ha detto.
"Siamo entusiasti perché questa chinasi appartiene a una famiglia di chinasi chiamate MAP chinasi, chinasi di segnalazione chiave che regolano una pletora di percorsi (all'interno delle cellule), " Egli ha detto.
Peti ha detto che la nuova scoperta potrebbe applicarsi ad altre chinasi. Ha detto che i molti enzimi chinasi nel corpo sono molto simili e probabilmente hanno percorsi di attivazione simili.
Ganesano, Peti e i loro coautori hanno pubblicato il documento, "Attivazione dinamica e regolazione della proteina chinasi attivata da mitogeni p38, " nel numero del 1 maggio del Atti dell'Accademia Nazionale delle Scienze .
I loro coautori sono Michael W. Clarkson e Rebecca Page dell'Università dell'Arizona; Micha B. A. Kunze, Daniele Granata e Kresten Lindorff-Larsen dell'Università di Copenhagen in Danimarca; e A. Joshua Wand dell'Università della Pennsylvania a Filadelfia.
La sovvenzione del National Institutes of Health NIH-R01GM100910 ha finanziato la ricerca. I dati sono stati raccolti presso le strutture UA Molecular Structures Core e Brown University Structural Biology Core.
Un'analogia spesso utilizzata per il funzionamento degli enzimi è quella di un lucchetto e una chiave. Una particolare molecola, il tasto, si inserisce in un sito nell'enzima, la serratura. Una volta che la chiave è nella serratura, l'enzima può iniziare a lavorare.
La chiave nella serratura è necessaria affinché un enzima funzioni, ma attivare un enzima non è sempre così semplice. Alcuni scienziati hanno suggerito che la dinamica, il modo e la velocità con cui un enzima si muove, è importante per l'attivazione degli enzimi chinasi.
Peti è interessato a come molecole come le chinasi governano i processi con le cellule, quindi ha voluto indagare sul ruolo che giocano le dinamiche. Imparare di più su come funzionano le molecole all'interno delle cellule può aiutare a sviluppare farmaci mirati per combattere il cancro e altre malattie.
Capire il ruolo che la dinamica gioca nell'attivazione di p38 è stato più difficile e ha richiesto più tempo del previsto.
Lo strumento utilizzato dagli scienziati per osservare un enzima in azione, spettroscopia NMR, è più difficile con una molecola grande come p38. Inoltre, il team ha dovuto sviluppare un nuovo software per computer per analizzare i risultati, disse Peti.
I ricercatori hanno osservato l'enzima in una serie di passaggi mentre varie molecole chiave si legavano a p38. Alcuni enzimi si attivano quando le molecole chiave si legano, ma non questo.
"Se pensi che sia un processo in cinque o sei passaggi per passare da zero a 100, pensavamo che a passi zero, uno, due o tre, otterremmo indicazioni o linee guida, " disse Peti.
Non è successo. Ha detto che i ricercatori hanno pensato di arrendersi.
"Niente funzionava, e sembrava che la nostra ipotesi fosse completamente sbagliata, " Egli ha detto.
"Quello che abbiamo è che non succede nulla da zero a uno, non succede niente da uno a due, non succede niente dalle due alle tre, non succede niente dalle tre alle quattro, " Disse Peti. "Quando vai dalle quattro alle cinque:Boom! All'improvviso era lì".
Una volta completati tutti questi passaggi, anche se la forma di p38 non è cambiata, la sua dinamica ha fatto, disse, e quel cambiamento finale nelle dinamiche era necessario perché l'enzima funzionasse.
Il prossimo passo della squadra, Peti ha detto, sta vedendo se il movimento delle chinasi gioca un ruolo nel diabete.