
Visualizza nella camera ad altissimo vuoto (campione di catalizzatore al centro). Credito:Università della Tecnologia di Vienna
In chimica, gli atomi di solito possono influenzare solo le loro immediate vicinanze. Alla TU Vienna, è stato scoperto un nuovo effetto con un'azione sorprendente a lungo raggio, che può rendere più efficaci i convertitori catalitici per autoveicoli.
Il gusto della glassa della torta al cioccolato non deve dipendere dal fatto che venga servita su un piatto di porcellana o d'argento. Allo stesso modo, per reazioni chimiche sulla superficie di grossi grani di metalli preziosi, il substrato (il cosiddetto supporto) non dovrebbe svolgere un ruolo cruciale. I grani catalitici hanno spesso un diametro che copre molte migliaia di atomi, e il supporto su cui poggiano non dovrebbe quindi influenzare le reazioni chimiche sull'altro lato lontano dall'interfaccia - almeno questo si credeva fino ad oggi.
Gli studi sperimentali eseguiti presso la TU Wien hanno portato a risultati sorprendenti. Processi chimici su grani di palladio, utilizzati anche per i catalizzatori dei gas di scarico, sono cambiati in modo significativo quando sono stati posizionati su materiali di supporto specifici, nonostante il fatto che il materiale del supporto sia quasi inattivo nella reazione chimica stessa. Questa nuova intuizione è stata ora pubblicata sulla rivista Materiali della natura .
Monossido di carbonio tossico
Per i veicoli che utilizzano un motore a combustione interna, il monossido di carbonio tossico (CO) deve essere convertito in anidride carbonica (CO2). Ciò si ottiene utilizzando catalizzatori contenenti polvere di palladio o platino. "Abbiamo studiato le reazioni chimiche sui grani di polvere, spesso utilizzati nella catalisi industriale, " afferma il prof. Günther Rupprechter dell'Institute of Materials Chemistry presso TU Wien. "I grani di metallo prezioso hanno un diametro dell'ordine di 100 micrometri - questo è molto grande per gli standard delle nanotecnologie, si possono quasi vedere ad occhio nudo".
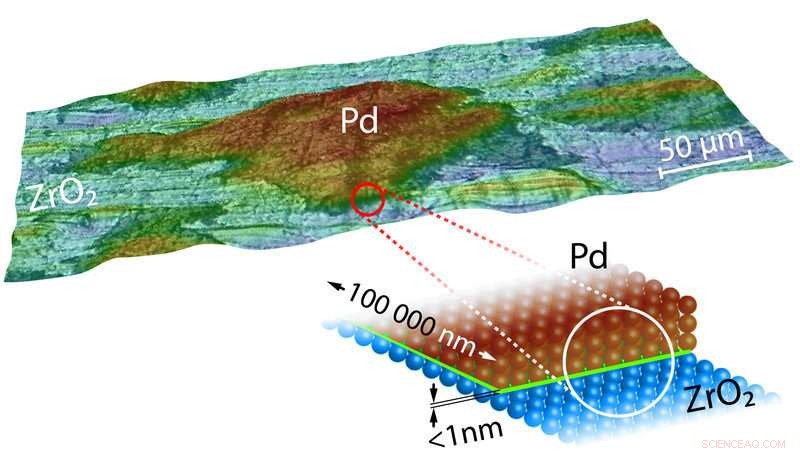
Immagine 3D e disegno del modello di un Pd-ZrO 2 catalizzatore. L'interfaccia/confine essenziale è colorata in verde nel modello. Credito:Università della Tecnologia di Vienna
Quando la superficie delle particelle di polvere è ricoperta da atomi di ossigeno, Le molecole di CO reagiscono con esse e si trasformano in CO2, lasciando siti vuoti (fori) nello strato di ossigeno. Questi siti devono essere rapidamente riempiti da altri atomi di ossigeno per sostenere la catalisi. Però, questo non è più il caso quando le molecole di CO riempiono questi buchi invece dell'ossigeno. Se ciò accade su larga scala, la superficie del catalizzatore non è più ricoperta da uno strato di ossigeno ma da uno strato di CO, e la CO2 non può quindi più formarsi. Questo fenomeno è chiamato "avvelenamento da monossido di carbonio", disattiva il catalizzatore.
Il supporto influenza l'intero chicco
Che ciò avvenga o meno dipende dalla concentrazione di CO nel gas di scarico fornito al catalizzatore. Però, come dimostrano gli esperimenti in corso, fondamentale è anche il materiale di supporto su cui vengono posti i grani di palladio. "Se i grani di Palladio sono posti su una superficie di ossido di zirconio o di ossido di magnesio, quindi l'avvelenamento del catalizzatore si verifica a concentrazioni di monossido di carbonio molto più elevate, " dice il prof. Yuri Suchorski, il primo autore dello studio. A prima vista, questo è molto sorprendente per grani di palladio così grandi. Perché la natura del supporto dovrebbe influire sulle reazioni chimiche che avvengono sulla superficie dell'intero grano metallico? Perché la linea di contatto tra il grano di palladio e il substrato, che è largo solo pochi decimi di nanometro, influenzare il comportamento dei grani di palladio che sono centomila volte più grandi?
Questo enigma potrebbe finalmente essere risolto con l'aiuto dello speciale microscopio elettronico a fotoemissione dell'Istituto di chimica dei materiali della TU Wien. Con questo dispositivo, la propagazione spaziale di una reazione catalitica può essere monitorata in tempo reale. "Possiamo osservare chiaramente che l'avvelenamento da monossido di carbonio inizia sempre sul bordo di un grano, esattamente dove entra in contatto con il supporto, " spiega il Prof. Yuri Suchorski. "Da lì, l'"avvelenamento da monossido di carbonio" si diffonde come un'onda di tsunami su tutto il grano".

Visualizza nella camera ad altissimo vuoto (campione catalizzatore al centro) e immagine PEEM "in situ" di un fronte di reazione CO. Credito:Università della Tecnologia di Vienna
Il monossido di carbonio attacca meglio al confine
È principalmente per ragioni geometriche che l'onda di avvelenamento inizia proprio lì:gli atomi di ossigeno al bordo del grano hanno meno atomi di ossigeno vicini di quelli sulla superficie interna. Quando i siti gratuiti si aprono lì, è quindi più facile per una molecola di CO popolare questi siti rispetto a quei siti da qualche parte nel mezzo della superficie libera, dove CO reagirebbe facilmente con altri atomi di O tutt'intorno. Inoltre, non è facile per altri atomi di ossigeno riempire le aree vuote al confine, poiché gli atomi di ossigeno vengono sempre in coppia, come molecole di O2. Perciò, riempire un sito vuoto, O2 ha bisogno di due siti liberi uno accanto all'altro, e non c'è molto spazio per questo al confine.
Il confine in cui il grano di palladio è a diretto contatto con il supporto è quindi di grande importanza strategica e proprio a questa interfaccia il supporto è in grado di influenzare le proprietà del grano metallico:"I calcoli dei nostri partner di cooperazione dell'Università di Barcellona mostrano che il legame tra gli atomi metallici del grano e lo strato protettivo di ossigeno sia rafforzato proprio al confine con il supporto, " afferma il prof. Günther Rupprechter. Gli atomi di palladio in intimo contatto con il supporto ossidativo possono quindi legare l'ossigeno più forte.
Si può presumere che questo non abbia importanza per i siti di metallo lontani dal confine del grano, perché il supporto può influenzare energeticamente solo gli atomi al confine - e questi sono solo pochissimi, rispetto al numero totale di atomi nel grano di palladio. Però, perché l'avvelenamento da monossido di carbonio inizia alla frontiera, questo effetto è di grande importanza strategica. Il bordo metallo-ossido è infatti il "punto debole" del grano, e se questo punto debole è rinforzato (le proprietà catalitiche degli atomi di metallo al bordo sono influenzate positivamente dal supporto), l'intero granulo del catalizzatore di dimensioni micrometriche è protetto dall'avvelenamento da monossido di carbonio.
"Diversi supporti di ossido sono già utilizzati nei catalizzatori, ma il loro ruolo esatto durante la catalisi in termini di avvelenamento da CO non è stato ancora osservato direttamente", afferma il prof. Günther Rupprechter. "Con i nostri metodi, il processo in corso e il suo effetto a lungo raggio simile a un'onda sono stati visualizzati direttamente per la prima volta, and this opens up promising new routes towards improved catalysts of the future".