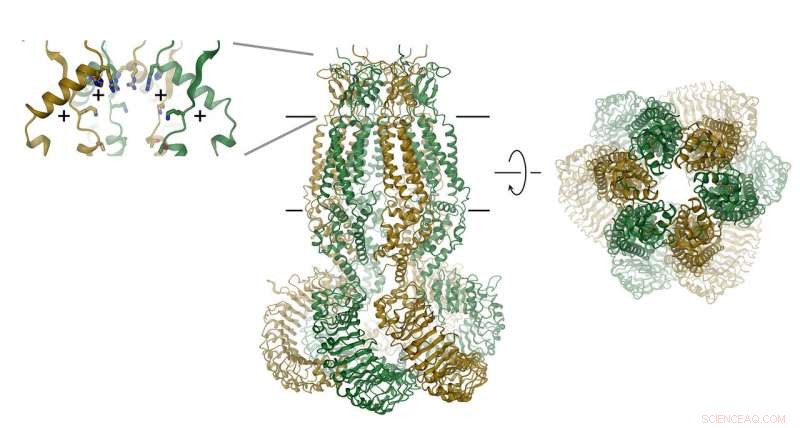
La proteina, che consiste di sei subunità, è mostrato come un nastro. La posizione della membrana è indicata da linee. Il filtro di selettività è rappresentato come riquadro (a destra). Le posizioni degli amminoacidi carichi positivamente sono indicate con (+). Credito:Raimund Dutzler, UZH
I biochimici dell'Università di Zurigo hanno determinato la struttura dettagliata di un canale del cloro a volume regolato. Questa valvola cellulare viene attivata in risposta al gonfiore per evitare che la cellula esploda. La proteina svolge anche un ruolo importante nell'assorbimento dei chemioterapici e nel rilascio di neurotrasmettitori dopo un ictus. La regolazione controllata della sua attività apre quindi una strategia promettente per nuove terapie.
Le cellule umane sono racchiuse da membrane e sono in equilibrio osmotico con il loro ambiente. Se la concentrazione di molecole di soluto (osmolarità) nel fluido che circonda le cellule diminuisce, le cellule iniziano a gonfiarsi; in casi estremi, questo può provocare lo scoppio delle cellule. Per evitare questo, le cellule attivano i canali del cloro regolati dal volume (VRAC) della famiglia di proteine LRRC8. Se il volume della cella aumenta a causa dell'afflusso di acqua, queste valvole cellulari si aprono per consentire agli ioni cloruro carichi negativamente e agli osmoliti non carichi di defluire, riportando la cellula al suo stato originale.
Sebbene scoperto solo cinque anni fa, importanti proprietà di queste valvole cellulari sono già state descritte. Per esempio, è risaputo che, oltre al loro ruolo nella regolazione del volume, I VRAC svolgono un ruolo importante per l'assorbimento dei farmaci utilizzati nella terapia del cancro e sono responsabili del rilascio incontrollato di neurotrasmettitori dopo un ictus. Nonostante questi progressi, la composizione molecolare dei VRAC e le basi della loro selettività sono rimaste elusive. I ricercatori del Dipartimento di Biochimica dell'Università di Zurigo hanno ora colmato questa lacuna nella nostra comprensione. Utilizzando la microscopia crioelettronica e la cristallografia a raggi X, il team guidato dal Prof. Raimund Dutzler ha determinato la struttura molecolare dettagliata di un VRAC. Inoltre, i ricercatori hanno analizzato le proprietà funzionali della proteina attraverso tecniche elettrofisiologiche.
I VRAC sono costituiti da sei subunità, che sono disposti attorno ad un asse che definisce il poro di permeazione ionica. La proteina, che si trova nella membrana, contiene un piccolo dominio extracellulare e un grande dominio intracellulare. Quest'ultimo svolge probabilmente un ruolo importante nell'attivazione del canale. Il dominio extracellulare restringe il canale e funziona come filtro di selettività. "I residui positivi in questo filtro attraggono ioni cloruro caricati negativamente e consentono la loro permeazione escludendo le molecole più grandi dall'ingresso nella cellula, " spiega Raimund Dutzler.
Con il loro lavoro, gli scienziati dell'UZH hanno fornito una base per una migliore comprensione dei meccanismi molecolari alla base del controllo del volume cellulare. "Questa conoscenza fornisce una base preziosa per lo sviluppo di potenziali nuovi farmaci, " dice Dutzler. In caso di ischemia cerebrale o ictus, gli astrociti nel cervello si gonfiano. Il conseguente deflusso incontrollato del neurotrasmettitore glutammato, che è mediato dai VRAC, ha conseguenze dannose per le persone colpite. Tali casi potrebbero trarre vantaggio dallo sviluppo di bloccanti specifici. Un'altra potenziale applicazione riguarda il ruolo dei VRAC nella terapia del cancro:un'attivazione specifica delle cellule dei VRAC potrebbe migliorare l'assorbimento delle sostanze terapeutiche nelle cellule tumorali.