I chimici del Boston College hanno sviluppato un nuovo, tecnologia derivata dai batteri per incorporare amminoacidi non canonici in proteine di un'ampia classe di organismi, compresi gli umani. Credito:biologia chimica cellulare
Le proteine, le macchine molecolari che guidano i processi alla base della biologia, sono costituite da soli 20 elementi costitutivi canonici chiamati amminoacidi. Per quasi due decenni, gli scienziati hanno cercato metodi per progettare nuovi amminoacidi per costruire proteine.
Un team di chimici del Boston College ha sviluppato una tecnologia per incorporare con precisione una gamma di utili amminoacidi non canonici nelle proteine prodotte negli eucarioti, l'ampia classe di organismi superiori che include gli esseri umani, la squadra ha riportato sul giornale Biologia chimica cellulare .
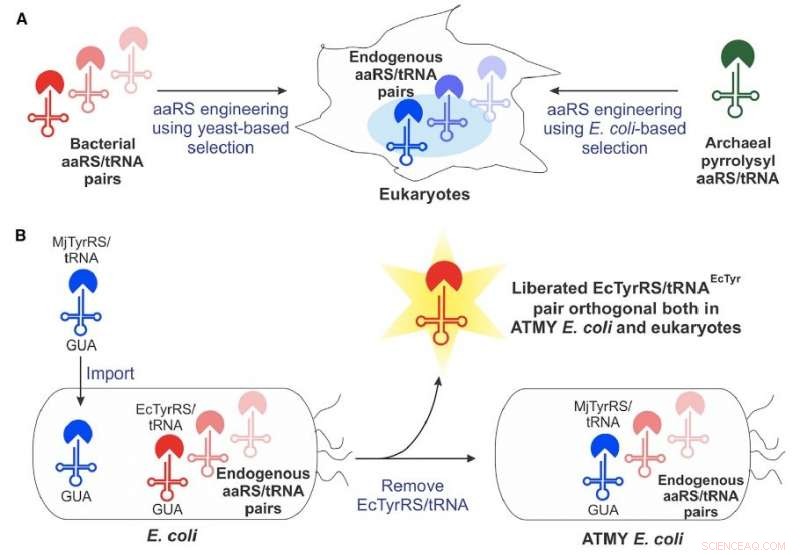
Circa 15 anni fa, gli scienziati hanno visto per la prima volta il potenziale di un macchinario genetico derivato da batteri, noto come coppia amminoacil-tRNA sintetasi/tRNA, per incorporare amminoacidi non canonici nelle proteine prodotte nelle cellule eucariotiche. Ma il metodo ha dovuto affrontare una serie di restrizioni tecniche che ne hanno limitato lo sviluppo diffuso.
Il team del Boston College ha superato molte di queste limitazioni sviluppando un nuovo ceppo di batteri E. coli che consente una facile ingegnerizzazione della coppia amminoacil-tRNA sintetasi/tRNA derivata dai batteri, secondo l'assistente professore di chimica Abhishek Chatterjee, che ha guidato il progetto. Questo nuovo approccio ha permesso l'incorporazione di vari amminoacidi non canonici, compresa la p-boronofenilalanina, nelle proteine prodotte nelle cellule umane e nel ceppo ingegnerizzato di E. coli .
Chatterjee ha affermato che il team è rimasto sorpreso dalla facilità del nuovo approccio, che è descritto nel nuovo rapporto "Resuscitare la coppia batterica tirosil-tRNA sintetasi/tRNA per espandere il codice genetico di entrambi E. coli ed eucarioti".
"Creare questo romanzo E. coli ceppo richiedeva la sostituzione della sua coppia nativa amminoacil-tRNA sintetasi/tRNA con una controparte di un organismo diverso, che ci aspettavamo sarebbe stato molto difficile, " ha detto. "Ma si è rivelato abbastanza fattibile. Questo apre questa tecnologia completa."
Chatterjee ha affermato che il team ha cercato di creare un nuovo metodo per progettare e monitorare le funzioni delle proteine come un modo per ampliare la comprensione scientifica dei processi che guidano le funzioni delle proteine nelle nostre cellule.
"Migliaia di proteine sono codificate nel genoma che ci rendono chi siamo, ma sappiamo molto poco di quel processo, " ha detto Chatterjee. "Nelle cellule umane, ce ne sono circa 20, 000 geni codificanti proteine. Quello che stanno facendo e come lo stanno facendo rimane difficile da studiare. Uno dei problemi principali è che se vuoi sapere cosa stanno facendo, devi spiarli. È necessario allegare una sonda che possa riferire su ciò che sta accadendo".
L'introduzione di tali sonde si è rivelata difficile, poiché il processo spesso danneggia la proteina bersaglio.
In ogni cella, le proteine sono costituite da 20 amminoacidi, un gruppo fisso guidato in ordine da istruzioni genetiche.
"L'idea è che possiamo introdurre un nuovo elemento costitutivo nelle proteine che la natura non ha, oltre ai 20 amminoacidi canonici che la natura usa, " Chatterjee ha detto. "Se possiamo farlo, abbiamo la capacità di introdurre in modo molto specifico un'ampia varietà di funzionalità non naturali in qualsiasi sito di qualsiasi proteina".
Il vantaggio immediato sarebbe quello di assistere i ricercatori che stanno ancora svelando i misteri della biologia cellulare e della funzione delle proteine.
"Potresti creare una proteina con un amminoacido non canonico in qualsiasi sito scelto, caricarlo con sonde molto piccole e dare un segnale ottico che dice dove sta andando, "Ha detto Chatterjee. "Potrebbe consentire di manipolare il modo in cui funziona la proteina. Potresti introdurre dei limiti, quindi qualunque cosa stia facendo la proteina, non se ne può più. E potresti rimuovere la sonda usando un segnale esterno come la luce. Questa tecnologia apre numerosi nuovi modi in cui si può iniziare a sondare e progettare la funzione delle proteine, che sarebbe molto impegnativo altrimenti."