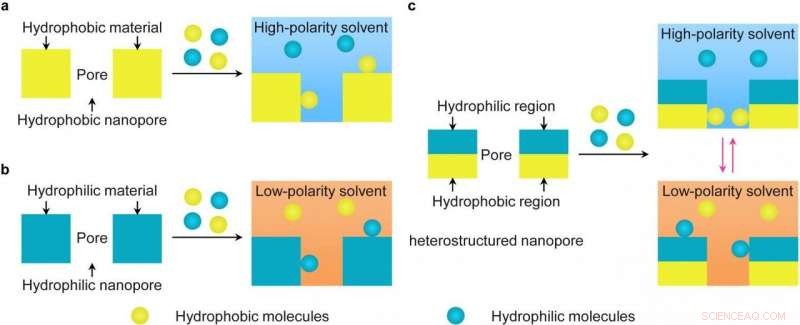
a) Materiali porosi idrofobici convenzionali. b) Materiali porosi idrofili convenzionali. c) Materiali porosi con nanopori eterostrutturati idrofilo-idrofobici. Credito:Dr. SONG Yongyang
Ricercatori cinesi hanno sviluppato particelle polimeriche porose polimerizzate interfaccialmente per la separazione di glicopeptidi a bassa abbondanza. Queste particelle polimeriche con nanopori eterostrutturati idrofilici-idrofobici possono separare in modo efficiente glicopeptidi a bassa abbondanza da campioni biologici complessi con molecole di fondo ad alta abbondanza.
I risultati sono stati pubblicati sulla rivista Materiale avanzato in un articolo intitolato "Particelle polimerizzate interfaccialmente con nanopori eterostrutturati per la separazione di glicopeptidi".
Le analisi quali/quantitative di biomolecole a bassa abbondanza da biofluidi complessi sono fondamentali nella diagnosi clinica e nella prognosi. Per esempio, il peptide Aβ glicosilato può aiutare a identificare il morbo di Alzheimer e il DNA tumorale circolante può aiutare a identificare il cancro.
I materiali polimerici porosi sono stati ampiamente utilizzati per la separazione. Però, la maggior parte dei materiali polimerici porosi esistenti ha composizioni o pori omogenei. Di conseguenza, separare in modo efficiente e specifico sottoinsiemi di biomolecole a bassa abbondanza da campioni complessi (come siero e plasma) è una grande sfida. Sebbene i recenti sforzi di modifica della superficie a livello di molecola per questi materiali polimerici porosi omogenei abbiano dimostrato una maggiore specificità di separazione, esiste ancora un adsorbimento aspecifico di molecole di fondo ad alta abbondanza.
I glicopeptidi endogeni sono biomarcatori significativi per molte malattie, come il morbo di Alzheimer e il cancro. Però, la loro separazione è sempre afflitta dalla scarsa abbondanza di glicopeptidi (generalmente da 10 a 500 pg/mL nei biofluidi) e dall'elevata abbondanza di molecole di fondo (come proteine e non glicopeptidi) nei biofluidi complessi.
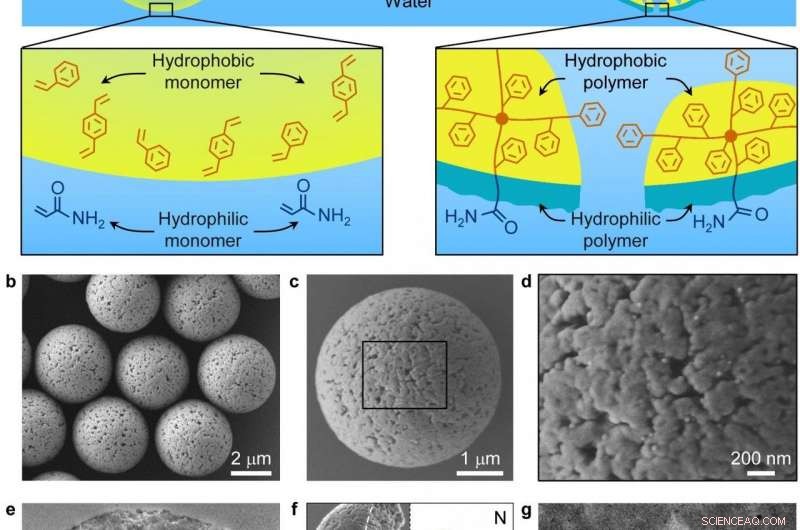
Particelle polimerizzate interfaccialmente con nanopori eterostrutturati idrofilici-idrofobici Credito:Dr. SONG Yongyang
I ricercatori dell'Istituto tecnico di fisica e chimica (TIPC) dell'Accademia cinese delle scienze hanno recentemente sviluppato un approccio di polimerizzazione interfacciale in emulsione per sintetizzare particelle polimeriche con superfici eterostrutturate idrofile-idrofobe e attuatori di film Janus bidimensionali. Sulla base di studi precedenti, i ricercatori hanno recentemente sintetizzato una serie di particelle polimeriche con nanopori eterostrutturati idrofilo-idrofobici mediante polimerizzazione interfacciale in emulsione, realizzare una separazione efficiente di glicopeptidi a bassa abbondanza da proteine ad alta abbondanza e non glicopeptidi.
L'efficiente separazione si ottiene consentendo l'adsorbimento locale dipendente dal solvente di biomolecole sulla superficie eterostrutturata all'interno dei nanopori tramite la commutazione della polarità del solvente. I ricercatori hanno scoperto che le particelle con grandi nanopori (dimensione media dei pori, 33 nm) può adsorbire proteine e non glicopeptidi in solventi ad alta polarità tramite interazioni idrofobiche, mentre le particelle con piccoli nanopori (dimensione media dei pori, 3 nm) possono adsorbire glicopeptidi in solventi a bassa polarità tramite interazioni idrofile.
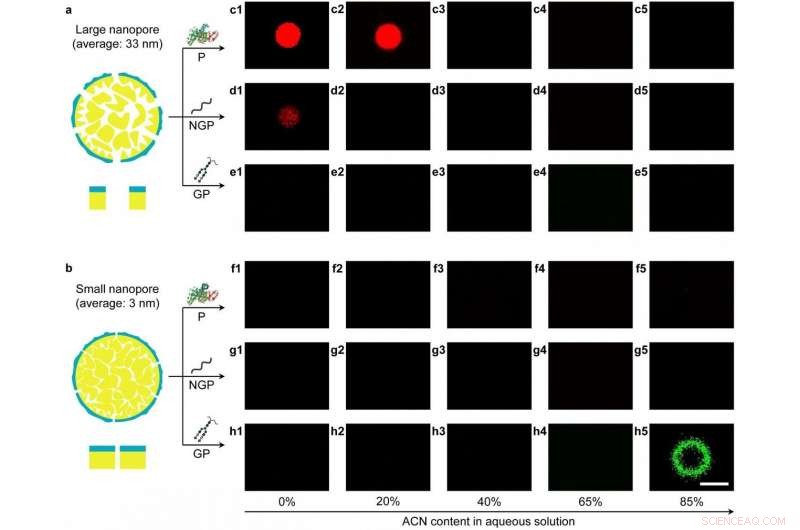
Adsorbimento di biomolecole a commutazione di solvente da parte delle particelle con nanopori eterostrutturati Credito:Dr. SONG Yongyang
Così, un protocollo in due fasi è stato progettato razionalmente per separare i glicopeptidi a bassa abbondanza dalle proteine ad alta abbondanza e dai non glicopeptidi. Primo, la regione idrofoba delle particelle con grandi nanopori ha rimosso proteine idrofobe ad alta abbondanza e non glicopeptidi in solvente ad alta polarità. Secondo, glicopeptidi idrofili a bassa abbondanza sono stati separati in modo efficiente tramite la regione idrofila delle particelle con piccoli nanopori in solvente a bassa polarità. L'efficienza di separazione delle particelle polimerizzate interfaccialmente è superiore ai materiali porosi esistenti utilizzati per la separazione di glicopeptidi.
Queste particelle forniscono un buon candidato per l'applicazione nella separazione di biomolecole a bassa abbondanza da campioni biologici e nella diagnostica clinica a valle.