Interpretazione artistica della barriera energetica che un atomo di fluoro reagente deve attraversare quando entra in collisione con una molecola di fluorometile nel suo cammino verso la formazione di un prodotto a seguito di una reazione chimica. I ricercatori dell'Università di Toronto hanno osservato l'espulsione collineare "knock-on" del prodotto di reazione (cerchiato in blu) nella continuazione della direzione della molecola del reagente in ingresso (cerchiata in rosso). Credito:Lydie Leung
Ricerca di un team di chimici dell'Università di Toronto, guidato dal ricercatore premio Nobel John Polanyi, sta gettando nuova luce sul comportamento delle molecole mentre si scontrano e si scambiano atomi durante la reazione chimica. La scoperta mette in dubbio un modello teorico vecchio di 90 anni del comportamento dello "stato di transizione", intermedio tra reagenti e prodotti nelle reazioni chimiche, aprendo una nuova area di ricerca.
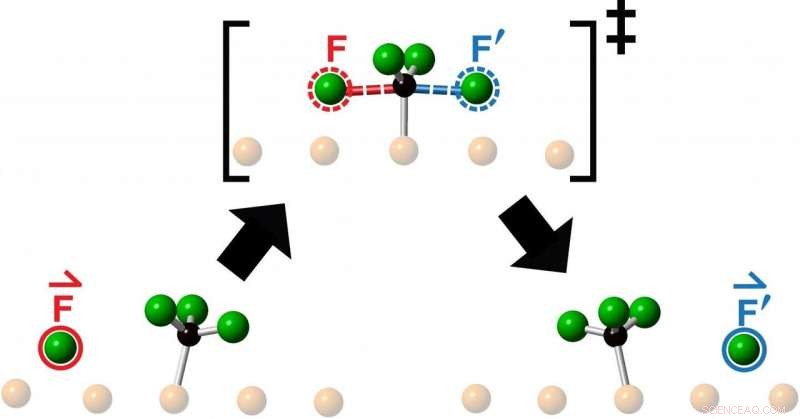
I ricercatori hanno studiato le collisioni ottenute lanciando un atomo di fluoro al centro di una molecola di fluorometil - composta da un atomo di carbonio e tre atomi di fluoro - e hanno osservato la reazione risultante utilizzando la microscopia a scansione a tunnel. Ciò che hanno visto dopo ogni collisione è stata l'espulsione di un nuovo atomo di fluoro che si muoveva collinearmente lungo la continuazione della direzione di avvicinamento dell'atomo di fluoro in arrivo.
"I chimici lanciano continuamente molecole ad altre molecole per vedere cosa succede o nella speranza di creare qualcosa di nuovo, "dice Polanyi, Professore universitario presso il Dipartimento di Chimica della Facoltà di Lettere e Scienze presso la U of T e autore senior di uno studio pubblicato questo mese in Chimica delle comunicazioni . "Abbiamo scoperto che puntare una molecola reagente al centro di una molecola bersaglio, limita il movimento del prodotto emergente a una sola linea, come se il prodotto fosse stato direttamente 'colpito'. La sorprendente osservazione che il prodotto di reazione emerge in linea retta, muovendosi nella stessa direzione dell'atomo reagente in arrivo, suggerisce che i movimenti che portano alla reazione assomiglino al semplice trasferimento di quantità di moto in avanti.
"La conservazione della quantità di moto lineare che osserviamo qui suggerisce uno 'stato di transizione' di breve durata, piuttosto che la vista precedente che c'è tempo sufficiente per la randomizzazione del movimento. Newton avrebbe Penso, sono stato contento che la natura permetta a un semplice evento a catena di descrivere qualcosa di così complesso come una reazione chimica, "dice Polanyi.

Lo studente laureato dell'Università di Toronto Matthew Timm prepara il microscopio a effetto tunnel per un esperimento che controlla l'esito di una reazione chimica selezionando il parametro di impatto delle collisioni molecolari. Credito:Diana Tyszko
Il gruppo, che includeva la ricercatrice senior Lydie Leung, studente laureato Matthew Timm e Ph.D. laureato Kelvin Anggara, aveva precedentemente stabilito i mezzi per controllare se una molecola lanciata verso un'altra si scontra frontalmente con il suo bersaglio o manca di una quantità prescelta, una quantità nota come parametro di impatto. Più alto è il parametro di impatto, maggiore è la distanza di cui la molecola in arrivo manca la molecola bersaglio. Per il nuovo lavoro, i ricercatori hanno impiegato un parametro di impatto pari a zero per dare una collisione frontale.
"Chiamiamo questo nuovo tipo di reazione chimica unidimensionale 'knock-on', poiché troviamo che il prodotto viene urtato lungo la continuazione della direzione di avvicinamento del reagente, "dice Polanyi. "I movimenti assomigliano al colpo delle sfere d'acciaio della culla di un Newton. Le sfere d'acciaio della culla non si incrociano, ma trasferiscono in modo efficiente la quantità di moto lungo una singola linea.
"Allo stesso modo, le nostre reazioni a catena trasferiscono energia lungo file di molecole, favorendo così una reazione a catena. Questa conservazione dell'energia di reazione nella chimica a catena potrebbe essere utile mentre il mondo si muove verso la conservazione dell'energia. Per adesso, serve come esempio di reazione chimica nella sua forma più semplice."
È noto da oltre un secolo che esiste una barriera energetica che i reagenti chimici devono attraversare per formare prodotti di reazione. Uno stato di transizione energizzato esiste brevemente nella parte superiore della barriera in una configurazione critica:nessuno stato di transizione, nessuna reazione.
Polanyi afferma che l'osservazione del "knock-on" collineare fornisce informazioni sul complesso di collisione reattivo, che dura circa un milionemilionesimo di secondo. "I nostri risultati ci dicono chiaramente che lo stato di transizione nella parte superiore della barriera energetica dura così poco tempo che non può scalare completamente i suoi momenti. Invece, ricorda la direzione da cui proveniva l'atomo di fluoro attaccante."
Negli anni '30, i chimici iniziarono a calcolare la probabilità di formare uno stato di transizione partendo dal presupposto che rimescolasse la sua energia, come una molecola calda. Nonostante fosse una supposizione, appariva ben consolidata e diede origine alla statistica "teoria dello stato di transizione" delle velocità di reazione. Questo è ancora il metodo preferito per calcolare le velocità di reazione.
"Ora, con la capacità di osservare i reagenti e i prodotti a livello molecolare, si vede con precisione come si avvicinano i reagenti e successivamente come i prodotti si separano, Polanyi dice. "Ma questo va contro il classico modello statistico vecchio di 90 anni. Se l'energia e la quantità di moto fossero randomizzate nello stato di transizione a caldo, i prodotti non presenterebbero una chiara memoria della direzione di avvicinamento dei reagenti. La randomizzazione energetica funzionerebbe per cancellare quel ricordo".
I ricercatori affermano che il movimento direzionale osservato dei prodotti di reazione favorisce un modello deterministico dello stato di transizione per sostituire il modello statistico di vecchia data. Inoltre, la dinamica di reazione osservata consente il passaggio dell'energia del reagente in successive collisioni collineari.