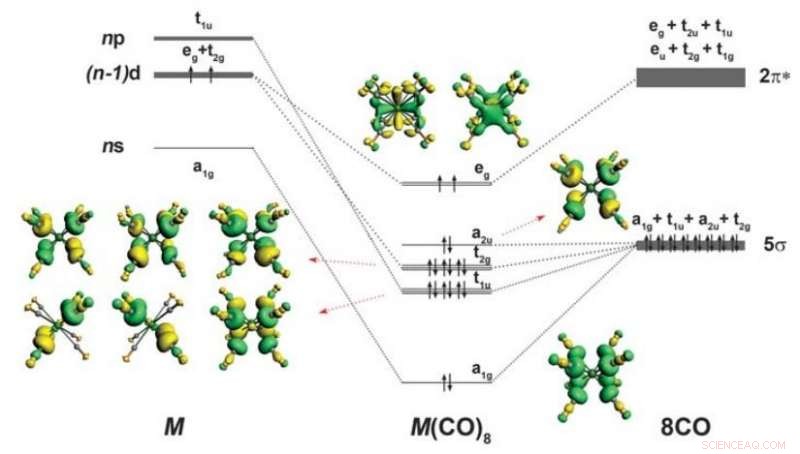
Schema di legame e forma degli orbitali di valenza occupati di M(CO) 8 (M =Ca, signore, o Ba). Divisione degli orbitali di valenza spd di un atomo M con la configurazione (n − 1)d 2 n 0 np 0 nella cubica ottacoordinata (O h ) viene fornito anche un campo di otto ligandi di CO. Vengono mostrati solo gli orbitali di valenza occupati rilevanti per le interazioni M-CO. Le frecce su e giù indicano gli elettroni con spin opposto. Credito: Scienza (2018). DOI:10.1126/science.aau0839
Un team di ricercatori della Fudan University e della Nanjing Tech University, sia in Cina, ha dimostrato che il principio dei 18 elettroni non è limitato ai metalli di transizione. Nel loro articolo pubblicato sulla rivista Scienza , il gruppo descrive il loro lavoro con il calcio, atomi di stronzio e bario e cosa trovarono. P. B. Armentrout con l'Università dello Utah offre un pezzo di prospettiva sul lavoro svolto dal team in Cina nello stesso numero della rivista.
Come ricorderanno molti studenti di chimica, gli elementi nella tavola periodica sono classificati in elementi del gruppo principale divisi per blocchi:includono i blocchi s e p, il blocco d, che include i metalli di transizione, ed ovviamente, il blocco f, che include attinidi e lantanidi. Anche, i principali elementi del gruppo calcio, è noto che lo stronzio e il bario formano legami usando i loro orbitali, e segui la cosiddetta regola dell'ottetto, in cui gli atomi finiscono con otto elettroni nel loro guscio di valenza. Metalli di transizione, d'altra parte, hanno altri cinque orbitali d che, riempiti, danno una formazione stabile con 18 elettroni. In questo nuovo sforzo, i ricercatori hanno dimostrato che anche gli elementi principali del gruppo come il calcio, lo stronzio e il bario possono seguire la regola dell'ottetto, dimostrando che la regola dell'ottetto non è limitata ai soli metalli di transizione. Il gruppo suggerisce che questa scoperta indica che la vecchia regola dell'ottetto, che si trova praticamente in tutti i libri di testo di chimica, non è effettivamente corretto in alcuni casi.
Nel loro lavoro, i ricercatori hanno dimostrato che i principali elementi del gruppo potrebbero formare complessi di 18 elettroni con il monossido di carbonio se posti in una camera molto fredda. Riferiscono che stavano studiando Ba(CO) + e Ba(CO) - usando l'analisi spettrale quando hanno trovato qualcosa che non andava:i numeri d'onda per la modalità di allungamento C-O erano stranamente spostati. Un'analisi delle loro scoperte ha suggerito che gli atomi di Ba avevano orbitali d piuttosto che gli orbitali s o p previsti. Per dimostrare le loro scoperte teoriche, hanno messo miscele di Ba, Sr e Ca in una matrice di neon freddo e hanno usato la spettroscopia a infrarossi per vedere meglio cosa stava succedendo - hanno trovato prove di otto ligandi di CO e back-bonding - una dimostrazione di metalli non di transizione che seguono la regola dell'ottetto.
© 2018 Phys.org