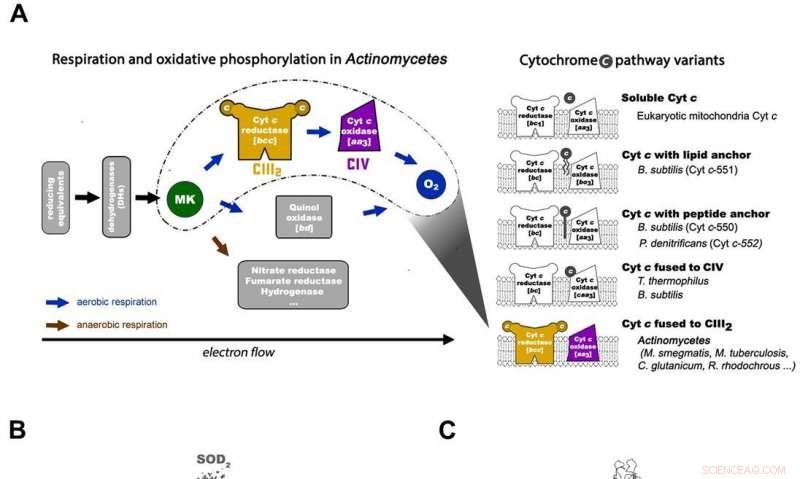
Respirazione negli attinomiceti e architettura complessiva della macchina respiratoria micobatterica CIII2CIV2SOD2. A) La catena respiratoria di trasferimento degli elettroni negli attinomiceti (a sinistra) e le 5 principali varianti della via del citocromo c procariotico con gli schemi di organizzazione negli organismi rappresentativi (a destra). La via del citocromo c di M. smegmas ha il suo citocromo c fuso con il complesso III per formare un complesso III di tipo bcc che interagisce con il complesso IV di tipo aa3 per assemblarsi in un supercomplesso CIII-CIV. MK =menachinone/menachinolo. B) L'intera architettura del Supercomplesso respiratorio CIII-CIV di tipo bcc-aa3 da M. smegmatis. La mappa crio-EM del supercomplesso mostra una forma dimerizzata lineare 2 volte di CIV1-CIII2-CIV1 con dimensioni 200 x 70 x 120 . CIII è visto in arancione, CIV è magenta e i fattori di associazione PRSAF1 in verde, LpqE in blu e SOD in grigio. C) Rappresentazione a cartone animato della vista laterale del supercomplesso (in alto) e una vista in sezione trasversale (in basso). Il MK si presenta come sfere solide verde brillante e fosfolipidi come bastoncini gialli. Nella vista in sezione trasversale in basso, i confini del CIII, CIV e fattore di associazione PRSAF1 sono rappresentati in linee tratteggiate di colore (arancione per CIII, magenta per CIV e verde per PRSAF1). Credito: Scienza , doi:10.1126/science.aat8923.
In un recente studio condotto da Hongri Gong e colleghi, un supercomplesso respiratorio è stato isolato dal batterio Mycobacterium smegmatis, e la sua struttura è stata visualizzata a una risoluzione di 3,5 utilizzando la microscopia crioelettronica (crio-EM). Il batterio è un parente stretto di M. tuberculosis e un modello popolare utilizzato per studiare molte altre specie batteriche. La struttura dettagliata ha rivelato come gli elettroni sono stati trasferiti nella cellula in un processo finora sconosciuto.
Tipicamente, l'energia chimica per sintetizzare l'adenosina trifosfato (ATP) e le reazioni cellulari di potenza viene estratta durante la respirazione cellulare accoppiando l'ossidazione di una fonte di energia (zuccheri, acidi grassi e amminoacidi) e la riduzione di un accettore di elettroni (ossigeno, zolfo, nitrati e solfati). Nella respirazione cellulare aerobica, l'energia viene estratta dai donatori di elettroni all'accettore terminale, ossigeno, attraverso la catena di trasporto degli elettroni (ETC) per creare un gradiente protonico transmembrana noto come forza motrice protonica (PMF) che guida la sintesi di ATP. I nuovi risultati ora pubblicati in Scienza rivelano un collegamento diretto per il trasferimento di elettroni tra enzimi per rappresentare una nuova modalità di catalisi della catena respiratoria.
I chinoni e i citocromi sono due tipi di trasportatori di elettroni negli ETC utilizzati per trasportare gli elettroni da e verso grandi strutture macromolecolari incorporate nella membrana. Quattro ossidoreduttasi di membrana sono coinvolte nella catena respiratoria mitocondriale per il trasferimento di elettroni. Questi includono il complesso I (NADH:ubichinone ossidoreduttasi, CI), complesso II (succinato:ubichinone ossidoreduttasi, CII), complesso III (ac 1 -tipo ubiquinolo:citocromo c ossidoreduttasi, avanti Cristo 1 -tipo CIII) e complesso IV (aa 3 -tipo citocromo c ossidasi, aa 3 -tipo CIV). Per funzione, CIII può ossidare l'ubiquinolo a ubichinone e passare gli elettroni al citocromo c solubile. Gli elettroni vengono quindi trasportati a CIV, dove l'ossigeno si riduce ad acqua. Il PMF transmembrana è generato dal pompaggio di protoni in CI, CIII e CIV.
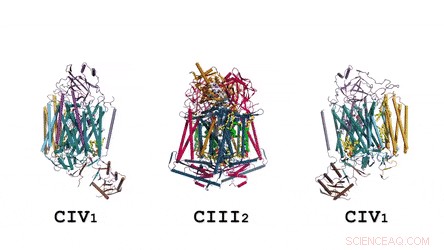
L'architettura del supercomplesso nella sua interezza:La rappresentazione del fumetto mostra il menachinone/menachinolo (MK) in sfere solide di colore verde brillante e fosfolipidi come bastoncini gialli. Credito: Scienza , doi:10.1126/science.aat8923
Nella catena respiratoria procariotica, la situazione è più complicata. Un percorso completo del flusso di elettroni non è stato ancora determinato nel tipo di cellula a causa della sua complessità. È quindi necessario comprendere la struttura completa di un "supercomplesso" coinvolto durante il trasferimento di elettroni batterico per aiutare l'obiettivo. Nello studio, i ricercatori hanno estratto e purificato il complesso da M. smegmatis per visualizzare l'architettura utilizzando la microscopia crioelettronica (crio-EM) con una risoluzione di 3,5 . La struttura ha fornito informazioni cruciali sul meccanismo del trasferimento diretto di elettroni all'interno di un supercomplesso respiratorio. Le dimensioni del supercomplesso erano nell'intervallo di 200 x 70 x 120 , in un'architettura lineare simmetrica completamente diversa dai supercomplessi respiratori precedentemente riportati. Per composizione, il dimerico lineare CIV 1 -CIII 2 -CIV 1 era disposto in modo tale che i singoli CIV fiancheggiassero il dimero CIII centrale su entrambi i lati. Le informazioni hanno rivelato un legame diretto tra gli enzimi durante il trasferimento di elettroni, rappresentando una nuova modalità di catalisi della catena respiratoria. I risultati strutturali dettagliati hanno il potenziale per aiutare con gli sforzi di scoperta di farmaci antimicobatterici.
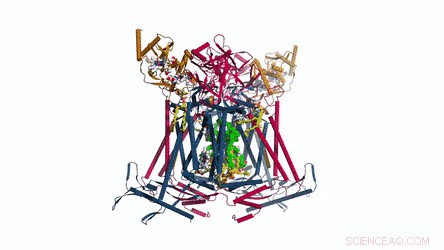
La composizione e la struttura del CIII dimero. Il menachinone/menachinolo si presenta come sfere solide verde brillante e i fosfolipidi sono bastoncini gialli. Credito: Scienza , doi:10.1126/science.aat8923
Durante gli esperimenti di coltura cellulare batterica, gli autori hanno utilizzato un ceppo mutante di M. smegmatis resistente al perossido di idrogeno simile a M. tuberculosis. Le cellule sono state coltivate e la membrana isolata come descritto in precedenza. Dopo la coltura cellulare, raccolta e lisi cellulare, pellet di membrana cellulare sono stati raccolti per estrarre supercomplessi respiratori. I supercomplessi sono stati caratterizzati mediante spettroscopia ottica, spettroscopia di massa e 3, Colorazione con 3'-diaminobenzidina (DAB). Per identificare i gruppi eme, le frazioni selezionate sono state analizzate registrando gli spettri prima e dopo la riduzione con ditionato come descritto in precedenza. I campioni purificati sono stati analizzati utilizzando la spettroscopia di massa nativa per indagare sull'architettura e i singoli componenti strutturali sono stati analizzati utilizzando protocolli precedentemente stabiliti.
Durante l'analisi crio-EM, i ricercatori hanno utilizzato acetato di uranile (1% p/v) per la colorazione negativa, utilizzando 5 µl del campione supercomplesso ad una concentrazione di 0,05 mg/ml, le immagini sono state scattate su un microscopio FEI Tecnai Spirit operante a 120 kV per la costruzione del modello iniziale. Le immagini acquisite sono state elaborate utilizzando una ricostruzione a bassa risoluzione del supercomplesso da 53 micrografie del campione colorato negativo. Per la ricostruzione completa del supercomplesso, gli autori hanno selezionato manualmente 7, 600 micrografie da 8, 200 micrografie originali durante l'elaborazione delle immagini crio-EM. Tutte le figure nello studio sono state create utilizzando PyMOL o chimera UCSF.

La composizione e la struttura del CIV. Rappresentazione a fumetti del complesso IV. I fosfolipidi sono mostrati come bastoncini gialli. Credito: Scienza , doi:10.1126/science.aat8923
Gli autori hanno rivelato la struttura crio-EM di un supercomplesso respiratorio CIII-CIV dei batteri M. smegmatis. Il percorso di trasferimento di elettroni intra-complesso variava dall'ossidazione del chinolo nel CIII alla riduzione dell'ossigeno nel CIV. I risultati hanno mostrato un nuovo meccanismo per biforcare il trasferimento di elettroni per garantire il completamento del ciclo Q (il movimento netto dei protoni attraverso un doppio strato lipidico) per la trasduzione di energia. L'associazione di una superossido dismutasi nell'architettura del sistema può proteggere dal danno ossidativo delle specie reattive dell'ossigeno (ROS). L'architettura dei siti di legame del chinone ha anche fornito un quadro per studi futuri sulla scoperta di farmaci antimicrobici basati sulla struttura.
© 2018 Science X Network