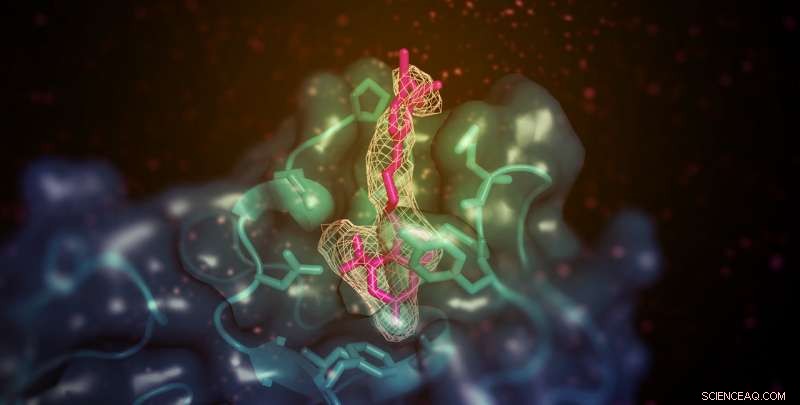
Una piccola molecola (mostrata qui in rosa) con la capacità di aumentare il colesterolo "buono" (HDL) in modelli animali si lega al dominio di legame alla membrana della lecitina:colesterolo aciltransferasi (LCAT; mostrato in verde acqua). Il sito è lontano dal sito attivo dell'enzima ma in qualche modo consente il trasferimento di substrati lipidici dall'HDL. Credito:Kelly Manthei e Stephanie King
Gli scienziati hanno determinato la struttura della forma attivata di un enzima che aiuta a restituire il colesterolo in eccesso al fegato, uno studio in eLife rapporti.
La ricerca rivela come una sostanza chimica simile a un farmaco stimoli l'azione dell'enzima lecitina:colesterolo aciltransferasi (LCAT). Suggerisce inoltre che i futuri farmaci che utilizzano lo stesso meccanismo potrebbero essere utilizzati per ripristinare la funzione LCAT nelle persone con deficit familiare di LCAT (FLD), una rara malattia ereditaria che li mette a rischio di problemi agli occhi, anemia e insufficienza renale.
LCAT aiuta la lipoproteina ad alta densità (HDL), nota come colesterolo "buono", a rimuovere il colesterolo dal sangue convertendo il lipide in una forma più facile da confezionare e trasportare. Ci sono più di 90 mutazioni conosciute in LCAT, che può causare una perdita parziale di attività (nota come "malattia dell'occhio di pesce") o una perdita totale (FLD). L'aumento dell'attività LCAT potrebbe quindi essere utile nel trattamento di persone con malattia coronarica e carenze di LCAT, ma i meccanismi con cui può essere attivato sono poco conosciuti.
"In questo studio, abbiamo usato la biologia strutturale per capire come un attivatore LCAT brevettato si lega all'LCAT e come promuove il trasporto del colesterolo, " dice l'autore principale Kelly Manthei, un borsista post-dottorato presso l'Istituto di scienze della vita dell'Università del Michigan, NOI. "Abbiamo anche chiesto se il composto potesse aiutare a recuperare l'attività degli enzimi LCAT che hanno comunemente osservate mutazioni osservate in FLD".
Il team ha utilizzato la cristallografia a raggi X per osservare l'enzima LCAT stabilizzato nel suo stato attivo con due diverse sostanze chimiche:la molecola attivatore, e un secondo composto che imita un substrato legato all'enzima. Le due sostanze chimiche hanno avuto un effetto maggiore sulla proteina se presentate insieme rispetto a quando presentate separatamente, che ha suggerito che si legano all'enzima in luoghi diversi.
Ulteriori analisi hanno scoperto che la molecola attivatore, a differenza di altri attivatori LCAT noti, si lega a una regione vicina a dove si attacca l'HDL. Però, l'attivatore non ha aiutato LCAT a legarsi all'HDL in modo più efficace, che ha portato il team a ipotizzare che aiuti invece a trasferire colesterolo e lipidi nel centro catalitico dell'enzima, in modo che possa convertirlo in carico per il trasporto in HDL.
Stabilita questa modalità di azione, i ricercatori hanno testato se questa molecola potesse aiutare a recuperare la funzione di trasporto del colesterolo di un enzima LCAT mutante. Hanno realizzato una versione dell'enzima con una mutazione comunemente osservata nei pazienti FLD, e poi testato la sua capacità di legarsi alle HDL e convertire il colesterolo in presenza o assenza della molecola attivatore. Erano entusiasti di scoprire che l'attivatore poteva in parte invertire la perdita di attività negli enzimi mutanti, con conseguente conversione del colesterolo paragonabile al normale enzima.
"I nostri risultati aiuteranno gli scienziati a progettare composti che possono indirizzare meglio l'LCAT in modo che possano essere di beneficio terapeutico per i pazienti con malattie cardiache e FLD, " conclude l'autore senior John Tesmer, Walther Professor in Biologia Strutturale del Cancro alla Purdue University, NOI. "I futuri sforzi saranno esaminare se i pazienti con altre mutazioni genetiche LCAT potrebbero trarre beneficio dai composti utilizzati in questo studio, e per progettare molecole con proprietà farmacologiche migliorate per un ulteriore sviluppo".