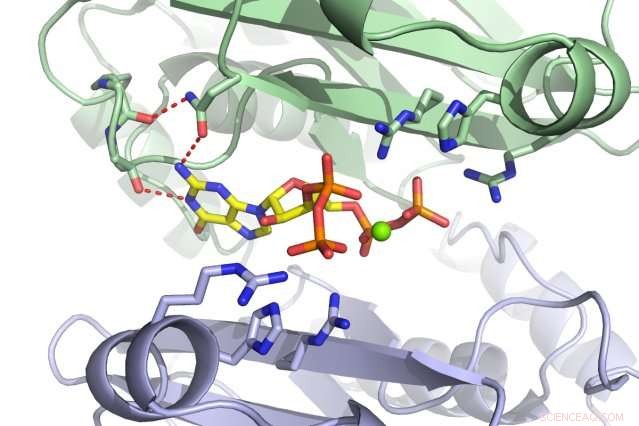
Un team del MIT ha scoperto che la piccola molecola ppGpp (rosso) si lega all'enzima PurF (subunità mostrate in verde e viola). Credito:Massachusetts Institute of Technology
Nel 1969, lo scienziato Michael Cashel stava analizzando i composti prodotti da batteri affamati quando ha notato due macchie che apparivano sul suo cromatogramma come per magia. Oggi, conosciamo uno di questi "punti magici, "come li chiamano i ricercatori, come guanosina tetrafosfato, o ppGpp in breve. Capiamo anche che è una molecola segnale presente praticamente in tutti i batteri, aiutando a sintonizzare la crescita e le dimensioni delle cellule in base alla disponibilità di nutrienti.
E ancora, nonostante decenni di studio, esattamente come ppGpp regola la crescita batterica è rimasto piuttosto misterioso. L'approfondimento richiede un elenco più completo delle molecole che ppGpp si lega per esercitare i suoi effetti.
Ora, i collaboratori dei dipartimenti di Biologia e Chimica del MIT hanno sviluppato un metodo per farlo, e hanno utilizzato il loro nuovo approccio per individuare oltre 50 bersagli ppGpp in Escherichia coli, circa la metà che non era stata identificata in precedenza. Molti di questi bersagli sono enzimi necessari per produrre nucleotidi, gli elementi costitutivi del DNA e dell'RNA. Durante i periodi in cui i batteri non hanno abbastanza nutrienti per crescere e dividersi normalmente, i ricercatori propongono che ppGpp impedisca a questi enzimi di creare nuovi nucleotidi da zero, aiutare le cellule ad entrare in uno stato dormiente.
"Con piccole molecole o metaboliti come ppGpp, è stato storicamente difficile determinare quali proteine si legano, "dice Michael Laub, un professore di biologia, un investigatore dell'Howard Hughes Medical Institute, e l'autore senior dello studio. "Questo è stato un problema irrisolvibile che ha trattenuto il campo per un po' di tempo, ma il nostro nuovo approccio ti consente di individuare i probabili obiettivi nel giro di poche settimane".
Il postdoc Boyuan Wang è il primo autore dello studio, che appare in Natura chimica biologia il 17 dicembre.
Il punto magico
Da quando ppGpp è stato scoperto quasi 50 anni fa, è stato dimostrato che sopprime la replicazione del DNA, trascrizione, traduzione, e varie vie metaboliche. Mette i freni alla crescita cellulare e consente ai batteri di persistere di fronte alla fame, fatica, e antibiotici. La sua influenza su numerosi processi regolatori è rimasta un po' un mistero, tuttavia, dopo tutto, non si limita a modulare un singolo percorso, ma coordina più operazioni contemporaneamente per orchestrare un arresto di massa della cellula.
Al fine di discernere quali proteine si legano ppGpp per effettuare tale cambiamento diffuso, i ricercatori hanno costruito quelli che chiamano "composti di cattura" che contengono ppGpp, permettendo loro di pescare i suoi bersagli dagli estratti batterici. Questi composti includevano un reticolante fotoreattivo che si attaccava saldamente alle proteine di interesse in presenza di luce, e un manico di biotina che ha aiutato gli scienziati a estrarre le proteine per identificarle. Più importante, erano uniti a ppGpp in modo tale da non interferire con la sua capacità di legarsi ai suoi bersagli. Questo metodo è più efficiente e accurato rispetto ai mezzi più tradizionali per distinguere i target ppGpp, che sono molto più ardui e mancano di sensibilità.
"Il nostro approccio risolve questi problemi perché non è più necessario eseguire protocolli così laboriosi per identificare i bersagli ppGpp e funziona anche nei batteri oltre E. coli, " dice Wang. "Anche se ppGpp è comune tra molte specie batteriche, sembra esercitare i suoi effetti attraverso diversi meccanismi, che complica le cose. I nostri composti di cattura forniscono un modo per svelare questa diversità, e in breve tempo".
Frenare la produzione di nucleotidi
Sebbene gli obiettivi 56 ppGpp che Wang ha identificato nel suo schermo controllano una miriade di processi cellulari, si è concentrato sull'enzima PurF, che avvia la biosintesi dei nucleotidi purinici contenenti basi di adenina e guanina, noto anche come A e G.
Quando i batteri sono stressati o affamati, entrano in uno stato dormiente per sopravvivere. Ma limitare semplicemente la traduzione e la trascrizione non è sufficiente; i nucleotidi vengono ancora generati e si accumuleranno se la loro sintesi non viene messa in pausa. Le cellule possono costruire nucleotidi in due modi:recuperando materiali esistenti o iniziando completamente da zero. PurF dà il via alla prima fase di quest'ultimo processo che porta ai nucleotidi A e G. Però, quando ppGpp si lega a PurF, fa sì che l'enzima cambi la sua forma, che gli impedisce di fare il suo lavoro, riducendo così la produzione di nucleotidi nella cellula.
"Questa è la prima volta che un enzima coinvolto in quella specifica via o funzione è stato identificato come bersaglio di ppGpp, " dice Wang. "Se limiti il consumo di nucleotidi ma non la loro produzione, il pool di nucleotidi sta per esplodere, che non va bene per la cellula. Quindi abbiamo dimostrato che ppGpp affronta effettivamente anche questo problema."
Oltre a PurF e ad altri enzimi necessari per la produzione di nucleotidi, i ricercatori hanno notato che ppGpp si lega anche a molti enzimi GTPasi coinvolti nella traduzione. Questo potrebbe indicare un meccanismo di sicurezza che rallenta la traduzione colpendo multipli, enzimi simili in maniera quasi ridondante di fronte alla fame.
Mentre Wang continua a perfezionare il suo metodo, mira ad aumentare la sua specificità e garantire che i suoi composti di cattura si leghino alle stesse proteine esatte che avrebbero all'interno di una cellula viva. Spera anche di esaminare le proteine leganti ppGpp in altri batteri, compresi gli agenti patogeni che si affidano a ppGpp per sopravvivere all'interno dei loro ospiti e propagare condizioni come la tubercolosi.
"Questo è un entusiasmante approccio chimico per comprendere meglio la funzione di una molecola di segnalazione conservata a lungo studiata nei batteri, "dice Jue Wang, professore di batteriologia all'Università del Wisconsin a Madison, che non era coinvolto nello studio. "Le loro scoperte e tecniche sono molto importanti per molti altri batteri, e migliorerà notevolmente la conoscenza di come i batteri usano questa molecola di segnalazione critica per mediare tutto, dalla sopravvivenza nell'intestino umano al causare malattie".
Laub aggiunge:"Ancora oggi stiamo scoprendo nuove molecole di segnalazione basate sui nucleotidi nei batteri, e ognuno di essi potrebbe eventualmente essere derivatizzato in modo simile per identificare i loro partner di legame".
Questa storia è stata ripubblicata per gentile concessione di MIT News (web.mit.edu/newsoffice/), un popolare sito che copre notizie sulla ricerca del MIT, innovazione e didattica.