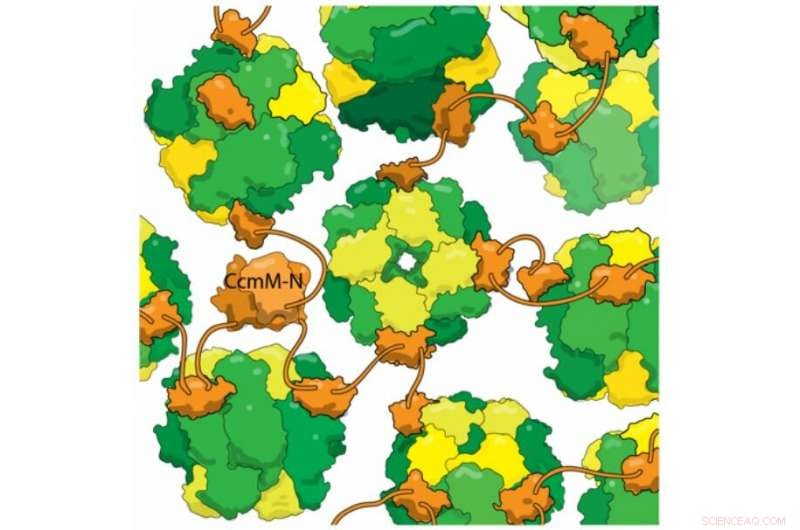
Nuove prove strutturali mostrano che la proteina cianobatterica CcmM (arancione) si lega agli enzimi RuBisCo completamente assemblati (giallo e verde) senza rimuovere le subunità RbcS (giallo). Questa miscela reticolata costituisce la base del carbossisoma, un compartimento utilizzato dai batteri per evitare la fotorespirazione. La fotorespirazione è un passaggio dispendioso nella fotosintesi causato quando RuBisCo fissa l'ossigeno invece dell'anidride carbonica, e si pensa che riduca la resa di alcune colture di oltre il 20%. Intrappolando l'anidride carbonica nei carbossisomi, i batteri ne aumentano la concentrazione, aiutando RuBisCo a riparare correttamente la CO2. Una maggiore comprensione dell'assemblaggio dei carbossisomi può aiutare a progettare colture a rendimento più elevato nel prossimo futuro.
Questa ricerca appare in Journal of Biological Chemistry . Credito:Ryan et al ., Journal of Biological Chemistry , 2019. (DOI:10.1074/jbc.RA118.006330)
I ricercatori che affrontano un futuro con una popolazione più numerosa e un clima più incerto stanno cercando modi per migliorare i raccolti, e stanno cercando batteri fotosintetici per soluzioni ingegneristiche.
Nel Journal of Biological Chemistry , un gruppo di ricerca canadese riferisce di come i cianobatteri finiscano uno dei passaggi più dispendiosi nella fotosintesi. Lo studio ha studiato l'assemblaggio di carbossisomi in cui i batteri concentrano anidride carbonica, aumentare l'efficienza di un enzima critico chiamato RubisCO.
"Essenzialmente tutto ciò che mangiamo inizia con RubisCO, "ha detto Matthew Kimber, professore all'Università di Guelph in Ontario, Canada, e autore senior del recente articolo.
L'enzima, che è composto da 16 subunità proteiche, è essenziale per la fotosintesi. Utilizzando l'energia catturata dalla luce, incorpora anidride carbonica in molecole organiche dalle quali la pianta poi costruisce nuovo zucchero. Sfortunatamente, non è terribilmente efficiente. O, dal punto di vista di Kimber, "RubisCO ha un compito davvero ingrato."
L'enzima si è evoluto in un mondo antico in cui l'anidride carbonica era comune e l'ossigeno era raro. Di conseguenza, non è molto pignolo nel discriminare tra i due gas. Ora che i tavoli atmosferici sono cambiati, RubisCO spesso cattura accidentalmente ossigeno, generando un composto inutile che l'impianto deve quindi investire energia extra per riciclare.
Rispetto alle piante, i cianobatteri commettono pochissimi errori del genere. Questo perché i batteri raccolgono il loro RubisCO in corpi densi noti come carbossisomi. I batteri pompano il bicarbonato (semplicemente CO2) nella cellula; una volta che entra nel carbossisoma, gli enzimi convertono il bicarbonato in anidride carbonica. Poiché l'anidride carbonica non può fuoriuscire attraverso il guscio proteico che circonda il carbossisoma, si accumula ad alte concentrazioni, aiutare RubisCO a evitare errori costosi.
L'interesse di Kimber per i carbossisomi è principalmente nella comprensione della logica della loro organizzazione. "In realtà sono macchine straordinariamente intricate, " spiega. "Il cianobatterio produce circa undici proteine dall'aspetto normale, e questi in qualche modo si organizzano in questo mega-complesso autoregolante che può superare le dimensioni di una piccola cellula".
Uno dei trucchi più impressionanti dei carbossisomi è l'autoassemblaggio, che il laboratorio di Kimber si è proposto di capire. Hanno esaminato una proteina chiamata CcmM, che raggruppa gli enzimi RubisCO in nuovi carbossisomi. Sapevano che parte di CcmM assomiglia molto a una subunità di RubisCO, tanto, infatti, che i ricercatori sospettano che gli antichi cianobatteri abbiano originariamente creato CcmM duplicando un gene RubisCO. La maggior parte degli scienziati nel campo credeva che CcmM si legasse all'enzima usurpando il punto di quella subunità. Ma quando il laboratorio di Kimber ha dato un'occhiata dettagliata a CcmM, utilizzando tecniche biofisiche per osservare la struttura e il legame della proteina, i risultati hanno mostrato che la saggezza ricevuta era sbagliata. Vero, CcmM era di forma simile alla piccola subunità RubisCO. Ma i complessi che formava includevano ancora tutte e 8 le piccole subunità, il che significa che invece di rubare un posto a una subunità RubisCO, CcmM doveva essere vincolante da qualche altra parte.
"Questo è molto strano dal punto di vista biologico, perché se CcmM è sorto duplicando la piccola subunità, quasi certamente originariamente rilegato allo stesso modo, " Kimber ha detto. "A un certo punto, deve essersi evoluto per preferire un nuovo sito di legame."
I ricercatori hanno anche scoperto che un linker tra i domini di legame in CcmM è abbastanza corto che "invece di avvolgere RubisCO, si lega (i singoli enzimi) insieme come perline su una corda. Con molti di questi linker che legano ogni RubisCO a caso, collega tutto in questo grande globo; ci avvolgi una conchiglia, e questo poi diventa il carbossisoma."
Scienziati di un'altra università hanno riferito lo scorso autunno di essere riusciti a produrre piante di tabacco con un carbossisoma ridotto nei loro cloroplasti. Quelle piante non sono cresciute particolarmente bene, e gli autori hanno concluso che avevano tolto troppi componenti del carbossisoma; anche se potrebbe essere costruito nel cloroplasto, era un freno alle piante invece che un aiuto. Avere una migliore comprensione di come proteine come il CcmM contribuiscono alla costruzione e alla funzione dei carbossisomi potrebbe aiutare i bioingegneri a sfruttare l'efficienza dei carbossisomi nella prossima generazione di piante ingegnerizzate.