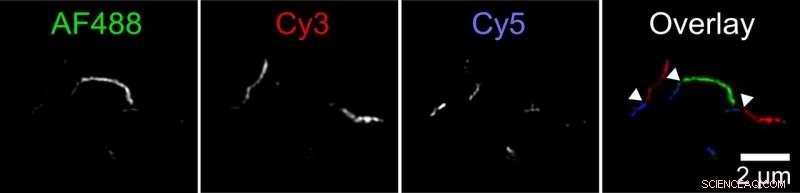
I biofisici hanno scoperto un nuovo meccanismo mediante il quale gli aggregati di proteina tau, chiamate fibrille, può crescere. Due fibrille possono attaccarsi da un capo all'altro. Questa figura mostra una fibrilla composta da fibrille più piccole etichettate in tre colori. Il ricercatore ha etichettato le proteine tau con tre diversi coloranti fluorescenti e ha permesso loro di aggregarsi in provette separate. Quindi ha mescolato insieme queste diverse fibrille colorate in una quarta provetta. Le immagini scattate con un microscopio a fluorescenza a super risoluzione mostravano lunghe fibrille con brevi sezioni di ciascun colore, indicando che le fibrille delle provette originali devono avere estremità unite per formare fibrille più lunghe. Credito:Carol Huseby/Ohio State University
All'inizio del corso della malattia di Alzheimer, molto prima che i futuri pazienti inizino a notare i sintomi, i grovigli neurofibrillari composti da aggregati di proteine tau iniziano a formarsi nelle loro cellule cerebrali. Quanto sono tossici questi aggregati e quanto bene si diffondono dipende dalle loro dimensioni. Però, gli scienziati che studiano la formazione di grovigli non sono stati in grado di spiegare perché nelle malattie compaiono aggregati di tau di dimensioni diverse.
Ma ora, ricercatori della Ohio State University hanno scoperto che invece di aggiungere solo una proteina alla volta, fibrille di varie lunghezze possono unirsi da un capo all'altro per creare un filamento più lungo. Il ritrovamento, che apparirà in Journal of Biological Chemistry di lunedi, aiuta a spiegare come le fibrille possono crescere fino a centinaia di nanometri e potrebbe anche aiutare i ricercatori a comprendere i meccanismi di un gruppo emergente di farmaci candidati progettati per inibire l'aggregazione della tau.
Gli scienziati possono utilizzare modelli matematici per descrivere processi biologici come la formazione di fibrille. Un semplice modello comune di aggregazione tau include due passaggi. Nel primo passo, due proteine tau si legano lentamente, e, nella seconda fase, molecole di tau aggiuntive si attaccano rapidamente.
Primo autore Carol Huseby, uno studente laureato nel laboratorio di Jeff Kuret, lavorando in collaborazione con Ralf Bundschuh, deciso di espandere questo modello matematico per includere altri modi noti in cui si comportano le fibrille tau. Gli scienziati hanno osservato, Per esempio, che a volte una fibrilla si frammenta in due. Altri tempi, una nuova fibrilla può nuclearsi nel mezzo di una fibrilla esistente.
Il semplice modello in due fasi prevedeva che una provetta riempita con proteina tau purificata avrebbe prodotto un gran numero di fibrille corte. Ma Huseby sapeva che quando i ricercatori osservano la proteina tau aggregata al microscopio, vedono un numero minore di lunghe fibrille. Quella discrepanza suggeriva che stava accadendo qualcosa nel mondo reale che non era stato preso in considerazione nel modello. Hanno ipotizzato che forse fibrille corte potrebbero attaccarsi da un capo all'altro per allungarsi.
Huseby condusse una serie di esperimenti per verificare l'ipotesi. In uno, prima ha etichettato le proteine tau con tre diversi colori fluorescenti e ha permesso loro di aggregarsi in provette separate. Quindi ha mescolato insieme queste diverse fibrille colorate in una quarta provetta.
Le immagini scattate con un microscopio a fluorescenza a super risoluzione mostravano lunghe fibrille con brevi sezioni di ciascun colore, indicando che le fibrille delle provette originali devono avere estremità unite per formare fibrille più lunghe. Gli esperimenti di controllo hanno stabilito che ciò non può essere spiegato dalla preferenza delle molecole etichettate per etichette simili.
Dopo che Huseby incorporò questo nuovo meccanismo nel modello, ha prodotto una descrizione molto migliore di ciò che le proteine tau purificate stavano realmente facendo quando formavano aggregati. Questo studio è il primo a dimostrare che le fibrille possono allungarsi di più di una singola proteina tau alla volta.
I ricercatori dell'Alzheimer stanno ancora cercando di capire se le fibrille di tau sono una causa o semplicemente un effetto della malattia. Una possibilità è che la trasmissione di fibrille da una cellula all'altra possa contribuire alla diffusione della malattia nel cervello. Una lunghissima fibrilla, secondo Kuret, è improbabile che si diffonda in questo modo. "Ma una volta che è rotto in piccoli pezzi, quelli possono diffondere, facilitando il loro movimento da cellula a cellula."
Questo studio ha utilizzato un solo tipo di tau. Sono note sei isoforme di diversa lunghezza, e la fosforilazione e altri cambiamenti aumentano la complessità della proteina. I ricercatori hanno in programma di incorporare queste variabili nel lavoro futuro, e iniziare a utilizzare il modello per capire come gli inibitori della tau modificano il comportamento degli aggregati proteici.