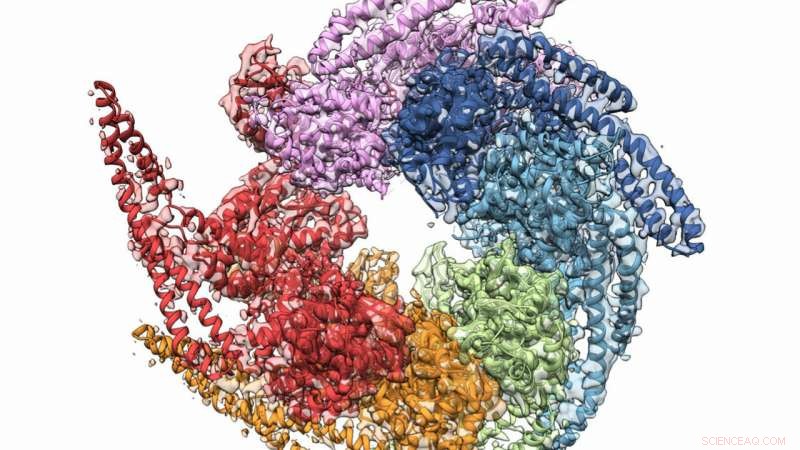
Le strutture combinate di cristallo e microscopia crioelettronica di Hsp104 si disaggregano dal fungo Calcarisporiella thermophila . Credito:Grigore Pintilie / Università di Stanford
Le tecniche di microscopia a raggi X ed elettronica aiutano a svelare la storia degli chaperon proteici.
Una combinazione di cristallografia a raggi X e microscopia crioelettronica (crio-EM) ha aiutato in uno sforzo collaborativo per ottenere la struttura a più alta risoluzione della proteina fungina Hsp104, che possono servire ad ostacolare la formazione di alcune malattie degenerative. Il gruppo, i cui membri includevano ricercatori dell'Argonne National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE), verificata anche una struttura elicoidale per gli esameri formati da proteine, una volta creduto piatto. I risultati sono stati pubblicati online il 27 dicembre, 2018 numero di Struttura .
Hsp104 è una proteina esamerica AAA+ nota come chaperone, che aiuta nei processi naturali di ripiegamento delle proteine per il corretto funzionamento delle cellule. Ma ancora più importante, forse, questa classe di esameri può riparare proteine mal ripiegate o aggregate che possono portare ad anomalie causate da proteine come la neurodegenerazione.
Varianti di questi chaperon sono comuni tra gli organismi multicellulari, ma Hsp104 non ha un omologo tra gli umani e altri animali. Sebbene sia più robusto degli chaperon di origine umana che possono guastarsi sotto stress cellulare, È stato osservato che Hsp104 piega le proteine umane.
"Abbiamo fatto alcuni esperimenti in cui abbiamo espresso proteine umane nel lievito, che fa ammalare il lievito perché si aggregano. Ma se esprimi Hsp104, quello del fungo Calcarisporiella thermophila , protegge il lievito da questa malattia dell'aggregazione, ", ha detto Argonne Distinguished Fellow Andrzej Joachimiak.
Joachimiak ha lavorato con un team composto da ricercatori di Argonne, l'Università di Chicago, Stanford University e l'Università della Pennsylvania per acquisire una migliore comprensione della struttura e della funzione di Hsp104.
Il team si è rivolto all'Advanced Photon Source di Argonne, una struttura per gli utenti dell'Office of Science del DOE, per sondare la struttura della proteina mediante cristallografia a raggi X. Hanno esaminato 30 campioni diversi, inclusi 14 accompagnatori Hsp104 da diverse fonti. In questo processo, un singolo cristallo è stato immerso in azoto liquido e sottoposto a raggi X duri da cui sono stati raccolti i modelli di diffrazione e la struttura ricostruita. Solo la proteina del Calcarisporiella fungo diffratto ad alta risoluzione, notò Gioacchino.
Per comprendere meglio la relazione strutturale della proteina all'interno di una cellula vivente, si sono poi rivolti a un'indagine sulla proteina in soluzione. I campioni sono stati sottoposti a screening mediante microscopia elettronica presso l'Università di Chicago e quindi inviati alla Stanford University, dove i microscopi crioelettronici hanno raccolto i dati molecolari ad alta risoluzione necessari per determinare la struttura attraverso calcoli complessi. Come per l'indagine sui cristalli, il Calcarisporiella campione ha fornito la migliore risoluzione.
Ora dotato della più alta risoluzione di Hsp104 sia in forma cristallina che in soluzione, il team è stato in grado di effettuare determinazioni precedentemente sconosciute o incerte sulle caratteristiche e sui comportamenti della proteina.
Prima della scoperta della squadra, i biologi ritenevano che Hsp104 supportasse cinque domini, sezioni indipendenti della proteina che svolgono funzioni specifiche. Ma le nuove strutture ad alta fedeltà non solo hanno rivelato solo quattro domini, ma un'immagine più chiara di come si relazionano tra loro.
Il dominio N terminale, Per esempio, si crede che si leghi a una proteina mal ripiegata e la aiuti a svilupparsi in una forma lineare. Ciò gli consente di passare attraverso uno stretto canale centrale nell'esamero creato da due domini AAA (ATPasi associati a varie attività cellulari). La proteina è guidata, o traslocato, attraverso questo canale all'altro lato dell'esamero, dove ora ha una nuova opportunità di piegarsi correttamente.
"La gente in precedenza ha affermato che un altro, il dominio del terminale C, era essenziale per la formazione dell'esamero, ma abbiamo dimostrato che questo non è vero, " disse Joachimiak. ?" Non interagisce con altre subunità, ma può funzionare come area di attracco per altri chaperon per aiutare a ripiegare le proteine".
Un'altra scoperta chiave ha contribuito a ribaltare una convinzione di vecchia data secondo cui gli esameri di Hsp104 fossero piatti. Entrambi i metodi di indagine hanno dimostrato inequivocabilmente che sono elicoidali, aiutare i ricercatori a capire come l'accompagnatore forma il canale "riparazione".
Il team prevede di continuare l'esplorazione dei numerosi e vari chaperon che esistono al di fuori del genoma umano. Credono che questi chaperon possano servire come strategia terapeutica con il potenziale per svelare letteralmente le proteine che possono portare a gravi malattie.
"È possibile che ci siano altri accompagnatori là fuori migliori dei nostri, e che saranno in grado di trattare le proteine che si aggregano nel cervello e causano malattie, " disse Joachimiak. ?"Sarebbe davvero fantastico."
La carta, "Struttura di Calcarisporiella thermophila Hsp104 disaggrega che antagonizza diversi eventi di misfolding proteotossico, " appare nel numero online del 27 dicembre della rivista Struttura . Oltre a Gioacchino, La ricercatrice di Argonne Karolina Michalska ha contribuito a questo studio.