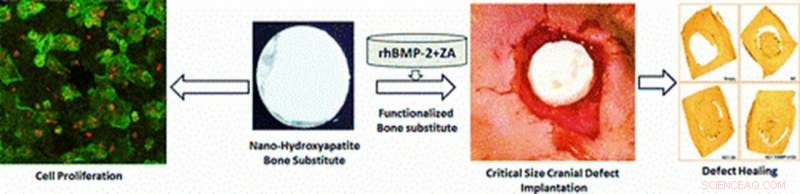
Illustrazione dei materiali multifunzionali sviluppati sperimentalmente nello studio per applicazioni in vivo di proliferazione cellulare e cranioplastica. La guarigione del difetto in un modello di roditore si osserva dopo 12 settimane di impianto di scaffold nel sito del difetto con proliferazione cellulare, radiografia, micro-TC e analisi istologiche. Credito immagine:ACS Applied Materials &Interfaces. Credito: Materiali multifunzionali , doi:https://doi.org/10.1088/2399-7532/aafc5b
I progressi nella scienza dei materiali e nella tecnologia di produzione hanno consentito strategie di ingegneria del tessuto osseo (BTE) che generano scaffold complessi con un'architettura controllata per la riparazione ossea. I nuovi biomateriali possono essere ulteriormente funzionalizzati con molecole bioattive per la biocompatibilità migliorando l'osteoinduttività (indurre l'osteogenesi per avviare la guarigione ossea). In un recente studio pubblicato su Materiali multifunzionali, Scienza IOP , Arun Kumar Teotia e collaboratori dei Dipartimenti di bioingegneria, ortopedia, ingegneria chimica e ingegneria biomedica, in India, Finlandia e Svezia hanno sviluppato un romanzo, multifunzionale, impalcatura composita a doppio strato (BCS). Il nuovo materiale conteneva nanocemento ceramico (NC) e lo scaffold composito macroporoso (CG) per imitare l'architettura ossea durante la riparazione ossea.
Per funzionalizzare gli scaffold, gli scienziati dei materiali hanno aggiunto la proteina morfogenetica-2 dell'osso umano ricombinante (rhBMP-2) (BMP) e l'acido zoledronico (ZA). Gli scienziati hanno proposto che gli scaffold compositi sosterrebbero la proliferazione delle cellule progenitrici degli osteoblasti, insieme al rilascio controllato di molecole bioattive caricate per indurre la rigenerazione ossea. Gli scienziati dello stesso gruppo di ricerca avevano precedentemente sviluppato un materiale multifunzionale simile per testare il suo impatto iniziale durante uno studio pilota in vivo.
In questo studio, Teozia et al. osservato una maggiore quantità di tessuto mineralizzato (MT) con scaffold funzionalizzati entro 12 settimane dall'impianto in vivo in un gruppo più ampio di ratti con difetti cranici critici di 8,5 mm. Gli scaffold compositi combinati a doppio strato (BCS) funzionalizzati con acido zoledronico (ZA) (per formare BCS+ZA) contenevano la più alta deposizione di MT (13,9 mm 3 ). Segue lo scaffold composito macroporoso (CG) funzionalizzato con BMP e ZA (CG+BMP+ZA) a 9,2 mm 3 e BCS+ZA+BMP con 7,6 mm 3 di deposizione di MT.
I valori di MT registrati nello studio durante la rigenerazione ossea erano significativamente più alti dei tassi di osteogenesi sui soli scaffold CG o BCS non funzionalizzati (senza molecole bioattive). I risultati hanno supportato le strategie BTE sviluppate nello studio per formare un'impalcatura multifunzionale osteo-promozionale che potrebbe essere impiantata in vivo per riparare difetti critici.
Una caratteristica unica del tessuto osseo è la sua capacità di guarire senza formazione di cicatrici come tessuto altamente dinamico con un notevole potenziale di rigenerazione. La formazione ossea naturale avviene tramite l'ossificazione endocondrale all'interno delle ossa tubulari (ad es. femore) o durante la deposizione di cartilagine, seguito da ossificazione. In un terzo processo, l'ossificazione diretta intramembranosa può verificarsi nelle ossa piatte (cranio, bacino) senza formazione di cartilagine. La rigenerazione è un processo lento nelle ossa piatte (cranio, pelvi) a causa di limitate cellule staminali mesenchimali (MSC), richiedono un maggiore reclutamento di cellule dal periostio o dalla dura.
Di conseguenza, guarigione di difetti di dimensioni critiche nelle ossa piatte, come il cranio è una sfida che richiede strategie BTE ottimizzate. I lembi ossei autotrapiantati sono stati inizialmente preferiti per la cranioplastica per ridurre al minimo le reazioni immunologiche, infezioni e riconoscimento di corpi estranei. Successivamente, gli scienziati hanno sviluppato innesti ossei di calvario vascolarizzati come scelta preferita per la ricostruzione cranica in ulteriori studi. Però, le strategie di innesto associate hanno introdotto complicazioni durante il riassorbimento del materiale post-impianto e la riparazione, insieme ad altre complicanze cliniche nel sito di contatto tra l'impianto e l'osso originale. La rigenerazione e l'infiltrazione cellulare in un lembo di calvaria dipendono in gran parte da cellule progenitrici che possono migrare dalla dura sottostante o dagli strati pericranici sovrastanti, differenziarsi in cellule osteogeniche attive per la guarigione. Se la migrazione cellulare è occlusa dalle due membrane (dura e pericranio), la formazione ossea sarebbe significativamente inferiore.
Gli scienziati avevano già determinato che le due membrane erano importanti per svolgere un ruolo specifico durante la rigenerazione, anche se con l'età il ruolo del periostio nella rigenerazione del cranio è meno significativo. In questo studio, Teozia et al. sviluppato l'ipotesi che una superficie osteoconduttiva potrebbe mantenere la diafonia tra la dura e gli strati pericranici per la vascolarizzazione precoce e il successo clinico. Per realizzare questo, hanno generato un'architettura di scaffold a doppio strato che integrava un nanocemento ceramico (NC) bifasico riassorbibile nano-idrossiapatite-solfato di calcio nello strato superiore e criogel poroso composito di seta-biovetro-idrossiapatite (CG) come strato sottostante.
Teozia et al. ha utilizzato il design a doppio strato per integrare la resistenza meccanica di NC come strato superiore protettivo e lo strato CG composito poroso come superficie per l'attacco cellulare, infiltrazione, proliferazione e vascolarizzazione. Gli scienziati si aspettavano che le superfici progettate mantenessero la comunicazione tra la dura sottostante e le membrane periostale sovrastanti. Hanno funzionalizzato i nuovi materiali e li hanno impiantati in vivo in ratti Wistar con difetti cranici critici per valutare l'effetto dell'architettura porosa a doppio strato sull'osteoconduzione e sulla formazione ossea in studi preclinici, studi traslazionali.
Durante la fabbricazione dei materiali, gli scienziati hanno modellato il NC in un'architettura di forma concavo-convessa per adattarsi alla forma del cranio e gli hanno permesso di impostare, per progettare impalcature multifunzionali a doppio strato per cranioplastiche. Hanno formato dischi BCS circolari composti da NC superiore e CG inferiore e hanno condotto procedure chirurgiche sui modelli animali. Durante l'intervento chirurgico, Teozia et al. impiantato i dischi dell'impalcatura nel sito del difetto ed eseguito ex vivo micro-TC e analisi radiologiche sul calvario asportato e raccolto dopo aver sacrificato i modelli animali, 12 settimane dopo l'impianto del disco.
Gli scienziati hanno completato le analisi radiologiche della formazione ossea nel sito del difetto per osservare la formazione di tessuto ossificato, utilizzando lo scanner in vivo nanoScan per le proiezioni radiografiche del difetto. Hanno utilizzato l'analisi micro-TC per rilevare la formazione di tessuto altamente mineralizzato (MT) e studiare il riempimento del difetto nel difetto circolare di 8,5 mm indotto chirurgicamente (regione di interesse). Entro 12 settimane, la mineralizzazione non ha raggiunto la chiusura perfetta nel modello animale. Gli scienziati hanno utilizzato un software di quantificazione delle immagini per mostrare la più alta quantità di formazione di tessuto mineralizzato nel gruppo BCS+ZA, seguito dal gruppo CG+ZA+BMP, seguito dai gruppi CG+ZA+BMP e BCS+ZA+BMP.
Post-raccolta, gli scienziati hanno fissato i campioni di cranio per l'analisi istologica e hanno condotto ematossilina ed eosina (H&E) e la colorazione tricromica di Masson dei calvari di ratto. Hanno dimostrato che sia lo scaffold composito poroso (CG) che lo scaffold a doppio strato (NC+GC) (BCS) si integravano bene con l'osso esistente nel sito del difetto. Gli scaffold fornivano superfici porose per un'accurata infiltrazione cellulare. Teozia et al. ha anche mostrato che gli scaffold funzionalizzati avevano una formazione di MT costantemente più elevata tramite saggi istologici a causa della presenza di fattori osteoconduttivi e osteoinduttivi nel composito di molecole bioattive rispetto ai gruppi non funzionalizzati. I risultati dell'istologia erano coerenti con i risultati della micro-TC nello studio.
In questo modo, Teozia et al. hanno mostrato che gli scaffold compositi multifunzionali potrebbero sostituire gli autoinnesti o gli allotrapianti di grandi dimensioni, difetti ossei nel cranio. Hanno dimostrato che i materiali multifunzionali erano in grado di indurre una vascolarizzazione precoce e migliorare la mineralizzazione in vivo. Come previsto, gli scaffold compositi consentivano una comunicazione osteoconduttiva porosa tra l'infiltrazione cellulare precoce dal periostio e gli strati durali sottostanti durante la rapida formazione ossea. I materiali multifunzionali promettono di migliorare la mineralizzazione ossea e la guarigione precoce dei difetti post-impianto. Teozia et al. proporre di condurre ulteriori studi in grandi modelli animali preclinici per ottimizzare e tradurre il nuovo biomateriale per applicazioni cliniche.
© 2019 Scienza X Rete