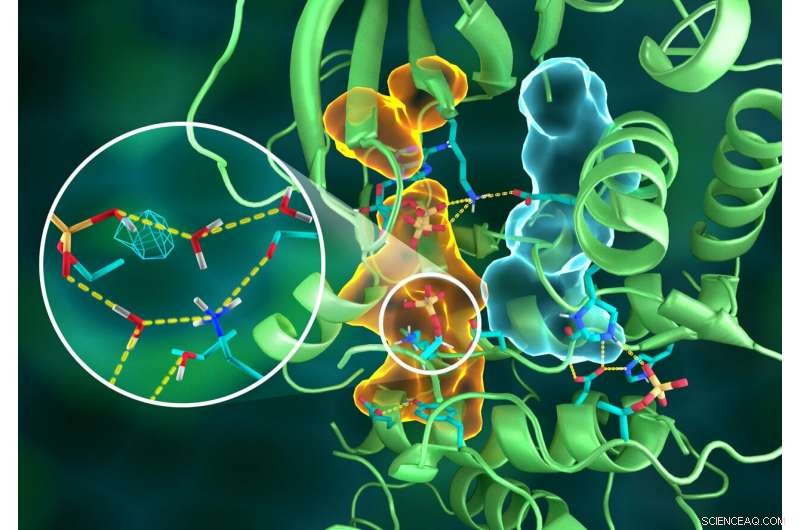
Illustrazione dell'intricata organizzazione della struttura PKA, in cui diverse parti della proteina sono collegate attraverso elaborate reti di legami idrogeno (linee gialle tratteggiate), incollati insieme dagli assemblaggi idrofobici (volumi azzurro e arancione) - tutti lavorano insieme per costruire il sito attivo funzionale. L'inserto mostra la protonazione del gruppo fosforilico trasferito (maglia ciano) e le sue numerose interazioni con l'acqua e i residui di amminoacidi del sito attivo. Attestazione:ORNL/Jill Hemman
Le osservazioni dirette della struttura e del meccanismo catalitico di un prototipo di enzima chinasi (proteina chinasi A o PKA) forniranno ai ricercatori e agli sviluppatori di farmaci capacità notevolmente migliorate per comprendere e trattare malattie mortali e disturbi neurologici come il cancro, diabete, e fibrosi cistica.
La scoperta è stata fatta da un team internazionale di ricercatori utilizzando la cristallografia neutronica macromolecolare presso l'Oak Ridge National Laboratory del Department of Energy e l'Institut Laue-Langevin di Grenoble, Francia. Basandosi su un'indagine decennale, gli sforzi combinati hanno rivelato caratteristiche precedentemente sconosciute della proteina chinasi archetipica, inclusa una mappa completa della struttura atomica e delle basi della chimica dell'enzima utilizzata nella segnalazione cellulare. I dettagli sono pubblicati sulla rivista Progressi scientifici .
Le chinasi sono un ampio gruppo di centinaia di enzimi responsabili dell'avvio e della regolazione di una miriade di processi cellulari. Le chinasi inviano segnali alle proteine tramite fosforilazione, aggiungendo un gruppo chimico reattivo costituito da fosforo e ossigeno in una posizione specifica su una proteina substrato per attivare la sua specifica funzione biologica.
I problemi sorgono quando le mutazioni genetiche fanno sì che le chinasi funzionino in modo improprio, che a sua volta porta alla malattia. Una chinasi malfunzionante, o uno che non può essere disattivato, potrebbe essere responsabile della sovraespressione di proteine che portano alla propagazione incontrollabile delle cellule cancerose. È vero anche il contrario nei disturbi neurologici in cui una chinasi malfunzionante provoca semplicemente la morte delle cellule.
"La creazione di farmaci mirati a specifiche chinasi è estremamente importante, " ha affermato il coautore Andrey Kovalevsky. "Questa comprensione dettagliata della struttura della PKA e delle sue dinamiche ci dirà di più su altri tipi di chinasi e dovrebbe aiutare gli sviluppatori di farmaci a progettare nuovi farmaci con una migliore specificità, che alla fine si tradurrebbe in terapie più precise con meno effetti collaterali".
I cambiamenti nella struttura della proteina dovuti alle mutazioni possono essere difficili da rilevare anche se gli effetti delle mutazioni sul comportamento dinamico della proteina possono essere piuttosto profondi. Però, questi comportamenti dinamici diventano più evidenti esaminando la rete complessiva di legami idrogeno in tutta la proteina.
I neutroni sono particolarmente sensibili agli elementi leggeri come l'idrogeno. Poiché circa il 50 percento di tutti gli atomi nelle proteine sono idrogeno, e la maggior parte delle reazioni chimiche catalizzate dagli enzimi coinvolgono l'idrogeno, i neutroni sono una sonda ideale e insuperabile per rilevare le posizioni degli atomi di idrogeno all'interno della struttura proteica e tracciare il loro movimento durante la catalisi.
Diffrazione di neutroni utilizzando il diffrattometro IMAGINE presso il reattore isotopico ad alto flusso di ORNL, una struttura per gli utenti dell'Office of Science del DOE, e il diffrattometro LADI-III dell'ILL ha permesso ai ricercatori di vedere le posizioni esatte degli atomi di idrogeno per rivelare la struttura completa della chinasi, nonché gli stati di protonazione di tutti gli amminoacidi in PKA e i ligandi legati al suo sito attivo, molti dei quali erano precedentemente sconosciuti.
"I neutroni ci hanno permesso di convalidare le previsioni dei raggi X delle posizioni degli atomi di idrogeno, oltre a determinare gli stati di protonazione di gruppi chimici che non erano noti, o in posti dove non ci aspettavamo di trovarli. Questo importante progresso chimico apre la strada a modelli molecolari più sofisticati e studi di simulazione della struttura e della funzione della proteina chinasi, ", ha detto l'autore corrispondente Susan Taylor.
"I neutroni offrono una visione senza precedenti della rete di legami idrogeno che circonda e all'interno del sito attivo della PKA e forniscono informazioni cruciali su come avviene la trasmissione allosterica delle informazioni attraverso la struttura proteica, " ha aggiunto il co-autore Gianluigi Veglia. "La combinazione della cristallografia di neutroni con la spettroscopia di risonanza magnetica nucleare fornirà una comprensione completa di come funzionano gli enzimi".