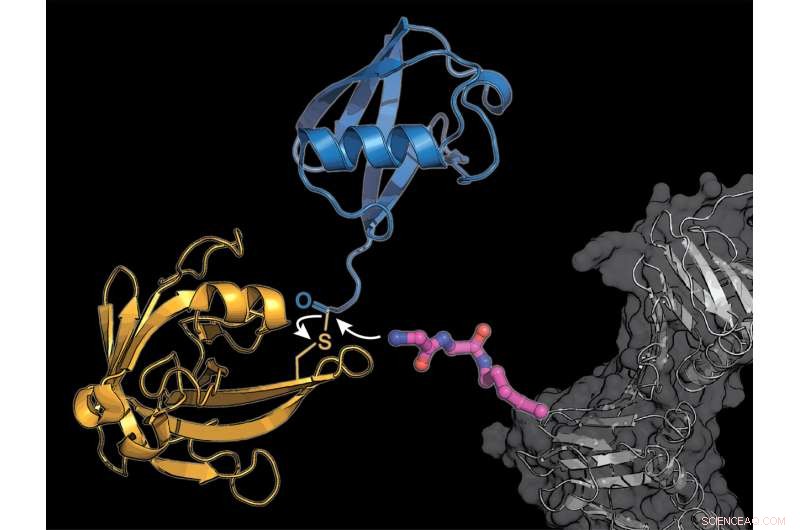
I ricercatori hanno dotato una proteina cellulare (grigia) di un elemento costitutivo dell'aminoacido lisina modificato (rosa), a cui l'enzima batterico sortasi (giallo) trasmette una molecola di ubiquitina (blu). Credito:K. Lang / TUM
Le cellule umane hanno un sofisticato sistema di regolazione che consiste nell'etichettare le proteine con la piccola molecola ubiquitina. In un primo, un team dell'Università tecnica di Monaco (TUM) è riuscito a marcare le proteine con l'ubiquitina in modo mirato nelle provette e nelle cellule viventi. La procedura apre le porte all'esplorazione del funzionamento interno di questo vitale sistema di regolamentazione.
Impianti, fungo, gli animali e l'uomo esprimono la proteina ubiquitina. Comprende una sequenza di 76 amminoacidi, rendendolo una biomolecola relativamente piccola. Ma la sua influenza è di vasta portata:il tipo, la posizione e il numero delle molecole di ubiquitina legate alle proteine ne determinano la stabilità, funzione, e posizione all'interno della cellula.
"Praticamente ogni processo nella cellula è direttamente o indirettamente influenzato dall'ubiquitina. Ecco perché i malfunzionamenti di questo meccanismo di etichettatura sono associati allo sviluppo e alla progressione del cancro e di molte altre gravi malattie, " spiega Kathrin Lang, Professore di Biochimica Sintetica all'Università Tecnica di Monaco di Baviera.
La scoperta dell'importante ruolo che questo sistema di regolazione cellulare svolge nella degradazione controllata delle proteine è stata riconosciuta con il Premio Nobel per la Chimica 2004. Ma, in molti casi i dettagli di come le modifiche dell'ubiquitina influenzino la funzione delle cellule rimangono poco chiari. Il team di Kathrin Lang ha ora sviluppato un metodo per attaccare etichette di ubiquitina a proteine mirate, una chiave per esplorare il sistema.
Un enzima batterico crea nuovi composti
Il team di Lang usa due trucchi per aggirare il complicato sistema naturale:incorporano un nuovo amminoacido modificato, in cui l'enzima sortasi derivato dai batteri può attaccare l'ubiquitina o una molecola simile all'ubiquitina.

Primo autore Maximilian Fottner e Prof. Kathrin Lang nel loro laboratorio. Credito:Andreas Battenberg / TUM
"La sfida più grande è stata quella di allineare i vari passaggi - l'incorporazione dell'aminoacido innaturale in una proteina bersaglio e il trasferimento dell'ubiquitina da parte dell'enzima sortasi - in modo tale che funzionino non solo in provetta ma anche nella vita cellule, " ricorda Maximilian Fottner, l'autore principale dello studio.
Intanto, i ricercatori dell'Università tecnica di Monaco hanno ottimizzato e brevettato il loro nuovo metodo per molte proteine cellulari diverse. "Abbiamo già avviato collaborazioni con medici e biologi cellulari che ora vogliono lavorare con noi per studiare gli effetti dei marcatori dell'ubiquitina sullo sviluppo del cancro e delle malattie neurodegenerative come il Parkinson a livello molecolare, "dice il prof. Lang.