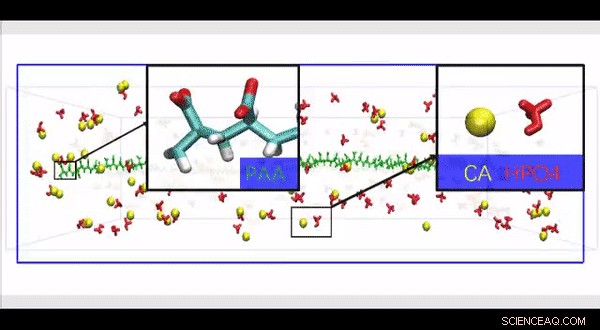
Simulazione completa della dinamica molecolare atomistica di una struttura di collagene HPAA ad alta risoluzione costruita per studiare l'effetto della presenza di grandi molecole di polielettrolita lungo la superficie della fibrilla di collagene sul movimento e l'infiltrazione di ioni in un modello biomimetico. Credito:progressi scientifici, doi:10.1126/sciadv.aav9075.
Gli organismi viventi formano minerali biologici durante la biomineralizzazione, dove gli elementi inorganici possono depositarsi selettivamente su specifiche macromolecole organiche sotto un preciso controllo. Il processo può essere suddiviso in biocalcificazione o biosilicizzazione in base alla componente inorganica, con collagene utilizzato come modello universale. Durante la mineralizzazione intrafibrillare, le matrici di collagene destinate alla mineralizzazione nei vertebrati contengono proteine della matrice legate alla superficie. Comprendere i complessi meccanismi della mineralizzazione intrafibrillare per formare il tessuto collageno duro come l'osso e la dentina è di notevole interesse in biomeccanica, con decenni di studi condotti per imitare o modellare il processo in laboratorio. In un recente studio, ora pubblicato in Progressi scientifici , D. Canzone e collaboratori dei Dipartimenti interdisciplinari di Biologia, Fisiche applicate, Scienze dei materiali e Ingegneria, Scienze Biomediche e Odontoiatria, in Cina, gli Stati Uniti e l'Italia, hanno sviluppato un modello biomeccanico per esaminare le interazioni collagene-ligando che contribuiscono alla mineralizzazione intrafibrillare.
Nello studio, hanno usato carica negativa, acido policarbossilico ad alto peso molecolare, reticolato al collagene ricostituito, per creare il modello biomimetico. Hanno condotto microscopia elettronica criogenica e simulazioni di dinamica molecolare, per mostrare che gli aggregati a catena formati dopo la reticolazione al collagene, lungo la superficie fibrillare per attuare la mineralizzazione fibrillare. Hanno osservato che la carica negativa, scaffold mineralizzati hanno permesso loro di ottenere una qualità superiore con migliori proprietà biomeccaniche, rispetto alla mineralizzazione su impalcature non modificate. Il lavoro sull'interazione collagene-ligando ha fornito agli scienziati approfondimenti sull'origine dei tessuti eterogeneamente mineralizzati e ha anche chiarito le potenziali cause della calcificazione ectopica (biomineralizzazione inappropriata) nei tessuti corporei non mineralizzati.
I biominerali che si trovano in natura contengono intrinsecamente calcio per formare fosfato di calcio (CaP) e fosfato ottacalcico come esempi. I biominerali contenenti CaP costituiscono specificamente i tessuti connettivi rigidi vertebrali, mentre il carbonato di calcio forma lo scheletro invertebrato. Le fibrille di collagene possono essere utilizzate come modelli di mineralizzazione grazie ai canali su scala nanometrica nelle loro strutture fibrillari per formare ibridi nanoingegnerizzati con forza e resilienza combinate. Però, il processo non può essere ottenuto semplicemente immergendo matrici di collagene in una soluzione sovrasatura di ioni minerali, richiedendo invece l'uso di inibitori della nucleazione per stabilizzare i complessi di associazione ionica e prevenire la loro cristallizzazione all'esterno delle fibrille. Di conseguenza, nell'ultima decade, gli scienziati hanno proposto diversi modelli in vitro per comprendere i meccanismi della mineralizzazione intrafibrillare. Nei precedenti modelli di studio, gli inibitori della nucleazione dei cristalli sono stati inclusi nel mezzo di mineralizzazione e non legati alle fibrille di collagene, allontanandosi dallo scenario tipico che si verificava nei sistemi biologici. Nel presente modello di studio, Canzone et al. ha quindi permesso agli inibitori di legare le fibrille di collagene per un'adeguata biomimetica.
Caratterizzazione del collagene PAA. (A) Spettri infrarossi di spugne di collagene PAA. Gli spettri sono stati normalizzati lungo il picco di collagene ammide A (~ 3300 cm-1, NH stretch accoppiato con legame idrogeno) Rispetto allo spettro del collagene nudo, gli spettri delle spugne di collagene legato all'HPAA (collagene HPAA) e al collagene legato all'LPAA (collagene LPAA) mostrano aumenti dell'ammide B, IO, II, e III picchi. (B) Superficie solida ζ potenziale del collagene HPAA, LPAA-collagene, e collagene nudo. La reticolazione di PAA alla molecola di collagene ha portato a potenziali ζ significativamente più bassi di -17,17 ± 1,98 mV per il collagene HPAA, -15,19 ± 1,22 mV per collagene LPAA, e -3,04 ± 0,37 mV per il collagene nudo. (C e D) Confronto di gruppi carbossilici (C) e amminici (D) tra collagene PAA e collagene nudo. Dopo la modifica anionica, le quantità di gruppo carbossilico (in mM/g di collagene) nel collagene HPAA (1.907 ± 0,084) e LPAA (1.807 ± 0,035) erano significativamente superiori a quelle del collagene nudo (0,460 ± 0,017). Credito:progressi scientifici, doi:10.1126/sciadv.aav9075. 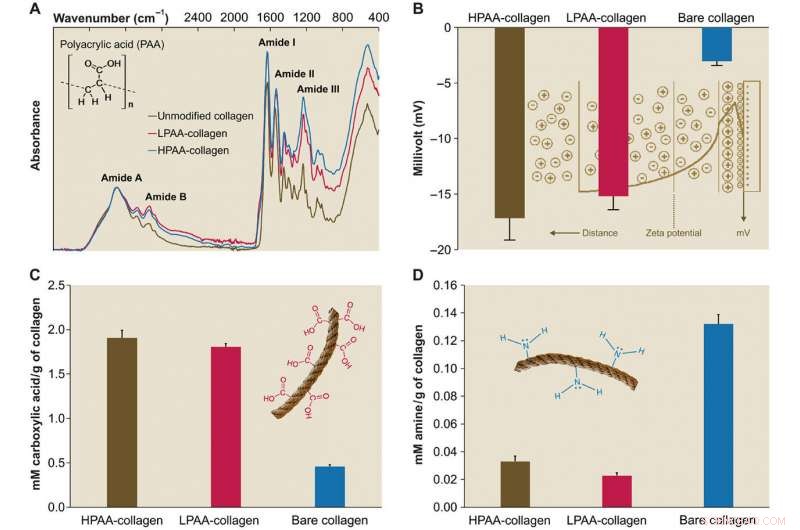
Poiché le proteine fisiologiche non collagene sono difficili da estrarre e funzionalmente complesse per l'uso negli studi di mineralizzazione biomimetica, Canzone et al. hanno utilizzato polielettroliti anionici come inibitori della nucleazione nel loro modello di mineralizzazione intrafibrillare. I polielettroliti anionici possono imitare la conformazione proteica altamente anionica e intrinsecamente disordinata che si trova nelle proteine non collagene. Nel modello proposto, gli inibitori della nucleazione dei polielettroliti legati al collagene ricostituito privo di proteine della matrice come modelli di mineralizzazione intrafibrillare. Canzone et al. ha prima simulato la dinamica molecolare per mostrare che un polielettrolita come l'acido poliacrilico (PAA) potrebbe riservare complessi di ioni calcio e idrogeno fosfato in aggregati a catena lungo la superficie della macromolecola al momento della sua introduzione in un mezzo di mineralizzazione CaP supersaturo.
Sulla base della dinamica molecolare simulata, Canzone et al. sviluppato un'ipotesi di prova che un inibitore della nucleazione legato alla superficie delle fibrille di collagene potrebbe stabilizzare i precursori della mineralizzazione del CaP vicino alle fibrille, per un'efficiente mineralizzazione intrafibrillare. Per verificare l'ipotesi, hanno invece utilizzato controlli con una versione non legata dello stesso polielettrolita utilizzato per stabilizzare i precursori del CaP inclusi nel mezzo di mineralizzazione.

Simulazione della fase tardiva della mineralizzazione intrafibrillare del collagene HPAA. Rendering 3D della fase tardiva della mineralizzazione intrafibrillare del collagene HPAA che mostra l'accumulo di aggregati di cluster di prenucleazione (giallo) lungo la superficie delle fibrille; i minerali intrafibrillari sono rappresentati in arancione. Credito:progressi scientifici, doi:10.1126/sciadv.aav9075.
Gli scienziati hanno utilizzato acido poliacrilico ad alto peso molecolare - PAA (HPAA) per simulare l'osteopontina e PAA a basso peso molecolare (LPAA) per simulare l'osteocalcina. Hanno reticolato chimicamente gli elettroliti polianionici per ricostituire fibrille o spugne di collagene di tipo I utilizzando composti organici ed hanno esaminato la costituzione del polimero utilizzando la spettroscopia infrarossa a trasformata di Fourier (FTIR). Canzone et al. ha utilizzato la microscopia elettronica a trasmissione (TEM) per osservare le fibrille di collagene legate a PAA che sono state colorate di rosso e le ha registrate come aggregati filamentosi densi di elettroni sulla superficie delle fibrille. Hanno quindi utilizzato la cromatografia liquida ad alte prestazioni per esaminare le caratteristiche di legame/rilascio delle spugne di collagene PAA.
Simulazione della dinamica molecolare della biomineralizzazione
Per comprendere le diverse fasi della mineralizzazione intrafibrillare del collagene legato all'HPAA (collagene HPAA), gli scienziati hanno creato filmati utilizzando i dati della tomografia elettronica delle diverse fasi della biomineralizzazione. Hanno simulato la (1) fase iniziale, per mostrare l'accumulo di aggregati di cluster di prenucleazione attorno alla fibrilla di collagene non mineralizzata, (2) fase intermedia - per mostrare una mineralizzazione intrafibrillare parziale e (3) fase tardiva - per mostrare una forte mineralizzazione intrafibrillare delle fibrille di collagene HPAA. Hanno dimostrato che il collagene LPAA non ha indotto la mineralizzazione intrafibrillare rispetto all'HPAA nello studio, e quindi non ha incluso i polimeri negli esperimenti successivi.

Simulazioni di dinamica molecolare. (A) Profilo delle strutture microfibrillari di collagene nudo con molecole d'acqua all'interno degli spazi intrafibrillari. nastri blu, triple eliche di collagene; puntini rossi, molecole d'acqua. (B) Vista laterale delle microfibrille di collagene nude. Le linee blu descrivono la scatola di simulazione lunga 67 nm. (C e D) Movimento del Ca2+ (sfere gialle), HPO42− (assemblaggi rossi), e assemblati precursori della mineralizzazione del CaP (assemblaggi giallo-rosso) attraverso le microfibrille di collagene con l'HPAA (catena verde) legata agli amminoacidi LYS1099 delle molecole di collagene. (E) In alto:Simulazione del movimento di vari ioni attraverso le strutture microfibrillari di collagene HPAA a tempi di simulazione designati. Sfere blu, sfere viola, sfere gialle, assemblea rossa, assemblee giallo-rosse, e la struttura della catena verde rappresentano gli ioni Na+, Cl- ioni, ioni Ca2+, Ioni HPO42−, precursori della mineralizzazione del CaP, e HPAA, rispettivamente. In basso:variazioni dinamiche del numero di Ca2+ (linea nera), HPO42− (linea rossa), Na+ (linea verde), e Cl− (linea blu) nelle regioni intrafibrillare ed extrafibrillare lungo il confine dell'asse a a 0, 30, 50, e 70 ns. (F) Movimento di Ca2+, HPO42−, e precursori di mineralizzazione CaP assemblati attraverso le microfibrille di collagene nudo con HPAA non legato nella regione extrafibrillare (controllo). (G) Confronto della distribuzione di vari ioni all'interno della regione intrafibrillare nei modelli HPAA legati al collagene e nei modelli di mineralizzazione HPAA non legati. (H) Confronto della deviazione quadratica media delle molecole di collagene nei modelli HPAA legati al collagene e HPAA non legati. (I) Confronto della superficie accessibile al solvente (SASA) delle molecole di collagene tra i due modelli. Credito:progressi scientifici, doi:10.1126/sciadv.aav9075.
Canzone et al. successivamente ha utilizzato simulazioni di dinamica molecolare del processo di mineralizzazione per comprendere la relazione struttura-funzione e ha convalidato la capacità dell'HPAA legata al collagene di aggregare i precursori della mineralizzazione del CaP. Per questo, hanno usato un modello atomistico completo del complesso di fibrille idrate HPAA-collagene. Nel modello unitario, hanno simulato Ca 2+ e HPO 4 2- ioni e precursori di mineralizzazione del CaP assemblati per formarsi attorno all'HPAA legata al collagene. Il lavoro ha rivelato la distribuzione degli ioni sodio, cloruro, calcio e HPO 4 2- ioni lungo l'asse del confine del modello unitario.
Esame dell'ultrastruttura
Per gli esami ultrastrutturali del modello biomimetico, Canzone et al. ha utilizzato la nanoindentazione per valutare i moduli di Young delle fibrille di collagene mineralizzate e non mineralizzate con la microscopia a forza atomica (AFM). I valori erano simili a quelli precedentemente riportati per le fibrille mineralizzate e non mineralizzate, calcolato utilizzando la nanoindentazione. Gli scienziati hanno utilizzato la spettroscopia di diffrazione dei raggi X per identificare la presenza di apatite sulle spugne mineralizzate. Lo studio ha mostrato che il collagene HPAA mineralizzato in una soluzione di CaP per sette giorni aveva un contenuto di minerali più elevato rispetto al collagene nudo. Quando Song et al. calcolato il rapporto apatite/collagene nei profili spettroscopici, le spugne di collagene HPAA indicavano livelli più elevati di mineralizzazione.
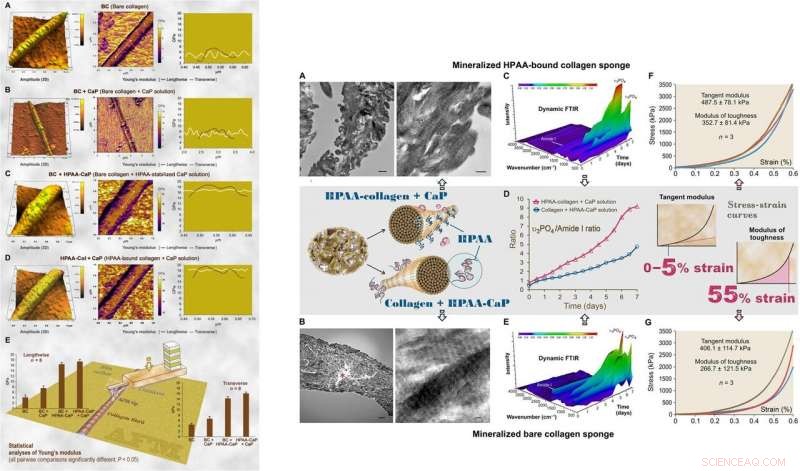
:A SINISTRA:AFM della topografia superficiale 3D e mappatura del modulo di elasticità (modulo di Young) di rappresentativi essiccati all'aria, collagene nudo mineralizzato e fibrille di collagene HPAA. (A) Le fibrille di collagene nude (BC) avevano una distribuzione quasi normale del modulo di Young trasversalmente attraverso la fibrilla. (B) Collagene nudo mineralizzato in soluzione di CaP senza inibitore di nucleazione (BC + CaP). (C) Collagene nudo mineralizzato con soluzione HPAA-CaP (BC + HPAA-CaP). (D) HPAA-collagene mineralizzato con soluzione di CaP senza inibitore di nucleazione (HPAA-Col + CaP). (E) Analisi statistiche del modulo di Young della fibrilla di collagene nelle direzioni longitudinale e trasversale (n =8). A DESTRA:Caratterizzazione di spugne di collagene HPAA mineralizzate e spugne di collagene nudo. (A) TEM di spugne di collagene HPAA mineralizzate. (B) TEM di spugne di collagene nudo mineralizzate. (C) La riflessione totale attenuata dinamica (ATR)-FTIR mostra la mineralizzazione progressiva di una spugna di collagene HPAA a intervalli di 12 ore per un periodo di 7 giorni. (D) Cambiamenti nel rapporto di apatite υ3PO4/collagene ammide I delle spugne di collagene anioniche mineralizzate e delle spugne di collagene non modificate. E) L'ATR-FTIR dinamico mostra l'andamento della mineralizzazione di una spugna di collagene nuda in soluzione HPAA-CaP. (F) Risposta stress-deformazione di spugne di collagene HPAA mineralizzate per determinare il modulo tangente e il modulo di tenacità (inserto, riga centrale). (G) Risposta stress-deformazione di spugne di collagene nudo mineralizzate. Credito:progressi scientifici, doi:10.1126/sciadv.aav9075.
Il modulo di tenacità, che tipicamente indica l'energia per unità di volume che un materiale può assorbire prima di rompersi, era anche significativamente più alto per le spugne di collagene HPAA, indicando la resistenza alla frattura del materiale. Tali caratteristiche spiegano l'elevata resilienza dei tessuti a base di collagene biomineralizzato che imitano la microarchitettura ossea per combinare le proprietà ossee di tenacità e resistenza nell'ingegneria rigenerativa. Canzone et al. accreditato le proprietà osservate di coesione/adesione alla reticolazione HPAA, che ha permesso di creare il composito collagene/minerale, simile all'osteopontina reticolata che si trova nell'architettura ossea.
Applicazioni dei nuovi costrutti biocompatibili
Poiché la biocompatibilità dei nuovi materiali è una caratteristica importante nella scienza dei materiali e nella bioingegneria, Canzone et al. hanno verificato interazioni cellule-materiale favorevoli sul collagene reticolato HPAA utilizzando la vitalità e la proliferazione delle cellule staminali durante la coltura cellulare di rigenerazione ossea in laboratorio. Quando gli scienziati hanno condotto saggi di deidrogenasi mitocondriale e di apoptosi su cellule staminali mesenchimali umane, non hanno osservato differenze significative tra il collagene HPAA non mineralizzato e le spugne di collagene nudo. A causa della loro compatibilità con le cellule simili agli osteoblasti umani, tali materiali possono essere utilizzati come rivestimenti biocompatibili per impianti chirurgici.
In questo modo, Canzone et al. hanno dimostrato un modello biomeccanico di potenziamento della mineralizzazione intrafibrillare utilizzando interazioni collagene-ligando per comprendere i meccanismi specifici del sito. Questo modello di interazioni collagene-ligando può anche far luce sulle potenziali cause della mineralizzazione ectopica, che interessa al momento. Nella prospettiva di Song et al., la mineralizzazione intrafibrillare tramite interazioni collagene-ligando può infiltrare i minerali in modo più coerente nelle matrici di collagene di massa per applicazioni nella medicina rigenerativa. I risultati aiuteranno a comprendere le proprietà biomeccaniche, riducendo al contempo i difetti per aumentare le caratteristiche biomimetiche di una matrice di collagene mineralizzato nell'ingegneria tissutale.
© 2019 Scienza X Rete