
Esperimento di luce solare. Le reazioni possono essere eseguite utilizzando la luce del sole in un semplice pallone di vetro. Credito:J. Waser/EPFL
La scoperta di nuovi bersagli biologici è una parte fondamentale della nostra battaglia in corso contro le malattie. Negli anni, gli scienziati hanno compiuto notevoli progressi verso la comprensione dei sistemi biologici, identificare costantemente nuovi obiettivi. La diversità strutturale di questi bersagli richiede un'ampia gamma di diversi agenti terapeutici.
"Le piccole molecole sintetiche sono ancora attori chiave, ma biomolecole come i peptidi, proteine e oligonucleotidi sono diventati un'importante area di ricerca, "dice il professor Jérôme Waser, direttore del Laboratorio di Catalisi e Sintesi Organica dell'EPFL. I peptidi sono particolarmente interessanti, con circa 140 valutati in studi clinici nel 2015. Tuttavia, i peptidi spesso non sono stabili nel sangue e non possono permeare bene le cellule, entrambi i quali diminuiscono il loro potenziale uso come droghe.
Una soluzione per superare queste difficoltà è modificare chimicamente la struttura naturale dei peptidi, un processo chiamato "funzionalizzazione". In chimica, una molecola viene "funzionalizzata" aggiungendo ad essa gruppi chimici, dotandolo così di nuove funzioni, capacità, o proprietà, come una maggiore stabilità nel corpo umano. Però, la funzionalizzazione dei peptidi è difficile, a causa della loro struttura complessa.
"Il motivo principale è la mancanza di selettività quando si tenta di modificare un peptide:contiene molte posizioni che reagiscono con le sostanze chimiche, dando luogo a inutili miscele, " spiega Waser. "Pertanto, metodi che consentano la funzionalizzazione selettiva di una singola posizione nei peptidi sono attivamente ricercati per accedere a farmaci a base di peptidi più efficienti e stabili".
Questo è ciò che il laboratorio di Waser ha ottenuto ora, utilizzando "reattivi EBX" - una classe di composti organici molto reattivi sviluppati dal gruppo e ora disponibili in commercio. Usando quei reagenti, i ricercatori hanno convertito l'acido carbossilico C-terminale dei peptidi in un triplo legame carbonio-carbonio - un alchino (in gergo chimico una "alchinilazione decarbossilativa"). La parte alchino è un gruppo funzionale molto prezioso che può essere utilizzato per modificare ulteriormente i peptidi. È stato ampiamente utilizzato nella scoperta di farmaci, scienze dei materiali e biologia chimica.
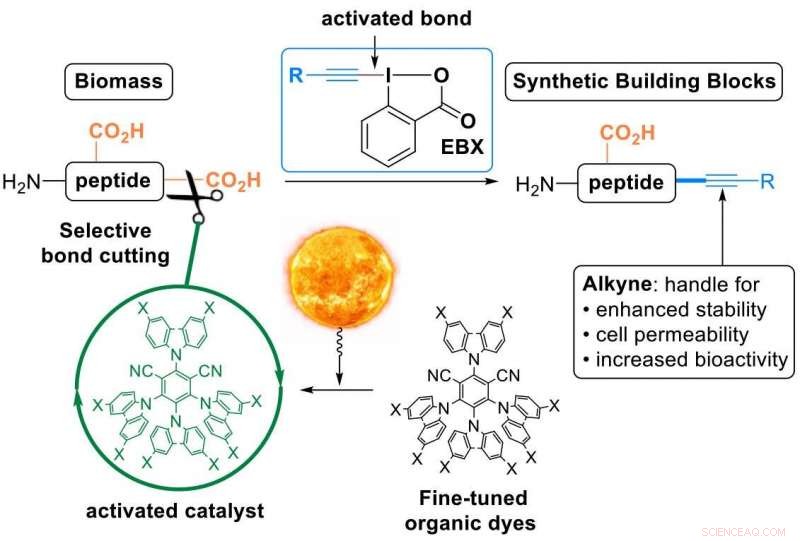
Unisci il mondo naturale e quello sintetico in un solo passaggio:modifica dei peptidi utilizzando coloranti organici eccitati con luce visibile e reagenti EBX. Credito:J. Waser/EPFL
I peptidi non reagiscono spontaneamente con i reagenti EBX, quindi gli scienziati hanno dovuto usare un catalizzatore. Per attivarlo, i ricercatori si sono rivolti alla luce o, in termini più tecnici, "catalisi fotoredox":la luce visibile viene assorbita dal catalizzatore, che poi attiva selettivamente un legame nelle molecole reagenti. "Utilizzare la luce come fonte di energia rinnovabile per eseguire reazioni organiche consente una risoluzione temporale e spaziale con condizioni di reazione molto blande, "dice Waser.
I ricercatori hanno apportato due innovazioni:in primo luogo, hanno progettato nuovi coloranti organici messi a punto come catalizzatori fotoredox. Questo era importante poiché le reazioni mediate dalla luce si basano solitamente su rari, catalizzatori di metalli di transizione tossici e costosi.
Secondo, i ricercatori hanno ottenuto questa prima "alchinilazione decarbossilativa" su peptidi nativi. Questa è una trasformazione in un unico passaggio particolarmente interessante di un composto naturale in un derivato sintetico in quanto offre una piattaforma per modificare le proprietà fisiche e chimiche del peptide attraverso un singolo, manipolazione facile da eseguire (tutti gli "ingredienti" devono solo essere mescolati e lasciati riposare alla luce naturale).
Il metodo può essere utilizzato con quasi tutti gli amminoacidi presenti sui peptidi, mantenendo la completa selettività verso la posizione C-terminale sulle catene laterali del peptide.
Con il loro nuovo metodo, gli scienziati sono stati anche in grado di ottenere derivati dal prezioso peptide bioattivo GRGDNP che impedisce alle cellule di legarsi alla fibronectina, un importante processo nella vasodilatazione dei vasi sanguigni, che potrebbe essere molto utile nello studio delle malattie cardiovascolari.