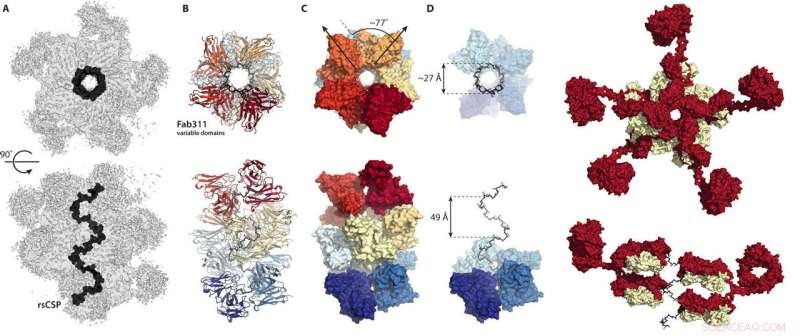
Queste cifre dal nuovo Progressi scientifici la carta mostra come gli anticorpi si legano insieme per bloccare la proteina circumsporozoite della malaria in una conformazione a spirale. Credito:laboratori Wilson/Ward, Scripps Research
Gli scienziati che studiano come il sistema immunitario umano si difende dalla malaria hanno scoperto un fenomeno raro:gli anticorpi che lavorano insieme per legarsi a un punto vulnerabile del parassita.
La nuova ricerca, pubblicato di recente in Progressi scientifici , mostra che gli anticorpi che lavorano insieme possono provocare una proteina sulla superficie cellulare del parassita bloccandola in una conformazione a spirale, come un largo cavatappi, impedendo al parassita di iniziare il suo ciclo vitale nell'ospite umano e, quindi, protezione contro l'infezione.
"Le prime immagini sono state piuttosto notevoli e ci hanno fornito le nostre prime intuizioni su come riconoscere il peptide di superficie estesa, "dice Andrew Ward, dottorato di ricerca, un professore di Scripps Research e corrispondente autore dello studio. "CryoEM è stato particolarmente adatto per risolvere questa struttura e apre la porta per risolverne altri simili. Per contribuire a creare un vaccino efficace, dobbiamo capire la giusta modalità di riconoscimento di questo peptide tipicamente flessibile da parte degli anticorpi".
Lo studio fa parte di uno sforzo internazionale per migliorare il vaccino contro la malaria più avanzato, chiamato RTS, S, che è stato negli studi clinici. Il vaccino candidato è attualmente efficace dal 25 al 50% circa a seconda del regime vaccinale, ma con centinaia di migliaia di persone che muoiono ancora di malaria ogni anno, i ricercatori stanno cercando modi per riprogettare o riformulare i vaccini.
Per fare questo, gli scienziati del campus californiano di Scripps Research stanno studiando gli anticorpi che il corpo umano produce quando viene somministrato l'RTS, vaccino S. Sono particolarmente interessati agli anticorpi che si legano al parassita della malaria all'inizio del suo ciclo di vita e proteggono dalle infezioni e se questi anticorpi imitano quelli prodotti dall'infezione naturale.
"Se riesci a bloccare quel primo stadio negli umani, puoi bloccare l'intero ciclo di vita del parassita, "dice Jonathan Torres, assistente di ricerca presso Scripps Research e co-primo autore dello studio.
È noto che questi anticorpi protettivi si legano alla proteina circumsporozoite della malaria, la proteina più abbondante sulla superficie del parassita, ma nessuno è stato in grado di avere uno sguardo chiaro su come lo fanno. Capire come questi anticorpi svolgono il loro lavoro può aiutare a guidare la progettazione di vaccini contro la malaria che possono innescare la stessa risposta anticorpale. Questa tecnica è chiamata progettazione razionale del vaccino.
Utilizzando una tecnica di imaging chiamata microscopia crioelettronica (EM), gli scienziati hanno ottenuto le prime immagini di un anticorpo legato alla proteina circumsporozoite. Il co-primo autore dello studio David Oyen, dottorato di ricerca, un ricercatore associato presso Scripps Research, dice di essere rimasto sorpreso da ciò che hanno rivelato le strutture crio-EM.
La forma della proteina è sempre stata difficile da immaginare a causa di un'ampia regione a bassa complessità al centro della proteina composta da molte quattro ripetizioni di amminoacidi che danno alla proteina un floscio, forma flessibile. Oyen pensava che gli anticorpi si sarebbero legati a quest'area "come perline su un filo".
Anziché, le strutture crio-EM hanno mostrato la regione ripetuta della proteina circumsporozoite bloccata in una struttura a spirale, con 11 frammenti di anticorpi (Fab311) che fuoriescono dai loro siti di legame, che consiste in due ripetizioni, e si irradia tangenzialmente dalla spirale allungata.
Ancora più sorprendente, la stabilità a spirale è impartita dai contatti tra gli anticorpi. "È come se unissero le braccia per formare un complesso più forte, " dice Oyen. Per quanto ne sanno gli scienziati, questa è la prima volta che viene chiarita la struttura tridimensionale della regione di ripetizione della proteina circumsporozoite, grazie ai contatti stabilizzanti inter-anticorpo. "È solo a causa delle sequenze multiple ripetute su questa proteina che questi contatti tra anticorpi sono possibili, " dice Oyen.
"Questa struttura è molto eccitante:la sequenza ripetuta di quattro amminoacidi da sola era stata trovata sperimentalmente molti anni fa per formare un beta-turn e le ripetizioni multiple previste per strutture di tipo elicoidale, ma questa struttura è molto diversa da quelle in quanto è un cavatappi molto largo e molto allungato come una grande scala a chiocciola, "dice Ian Wilson, DPhil, Hansen Professore di Biologia Strutturale presso Scripps Research, presidente del Dipartimento di Biologia Strutturale e Computazionale Integrativa e co-autore corrispondente dello studio.
L'anticorpo mostrato con la proteina circumsporozoite in questo studio è solo uno dei tanti che il team prevede di visualizzare con il crio-EM. Sperano di confrontare le strutture per vedere se gli anticorpi protettivi condividono qualche caratteristica. Alcuni potrebbero avere contatti tra anticorpi, alcuni potrebbero no.
"Vogliamo rendere il vaccino contro la malaria il migliore possibile, " Dice Oyen. "E speriamo di poter utilizzare queste strutture crio-EM per progettare candidati vaccini nuovi o migliorati".