Tendenze della tavola periodica. Credito:Sandbh/Wikipedia, CC BY-SA
La notizia ha dato la notizia che un vagone ferroviario, caricato con sodio puro, era appena deragliato e ne stava rovesciando il contenuto. Un giornalista televisivo mi ha chiamato per una spiegazione del motivo per cui ai vigili del fuoco non è stato permesso di usare l'acqua sulle fiamme esplose dall'auto sbranata. Mentre ero in onda ho aggiunto del sodio a un po' d'acqua in una capsula di Petri e abbiamo osservato la reazione viziosa. Per un ulteriore effetto drammatico, Ho anche messo del potassio nell'acqua e ho stupito tutti con le fiamme esplosive bluastre.
Perché i metalli del gruppo I, noto anche come metalli alcalini, sono molto reattivi, come il sodio del vagone o il potassio, non si trovano in natura allo stato puro ma solo come sali. Non solo sono molto reattivi, sono morbidi e lucenti, possono essere facilmente tagliati anche con un coltello smussato e sono i più metallici di tutti gli elementi conosciuti.
Sono un chimico che ha passato la sua carriera a costruire nuove molecole, a volte utilizzando elementi del gruppo I. Studiando il comportamento e le tendenze degli elementi del gruppo I, possiamo avere un assaggio di come è organizzata la tavola periodica e di come interpretarla.
Le basi
La disposizione della tavola periodica e le proprietà di ciascun elemento in essa contenuta si basa sul numero atomico e sulla disposizione degli elettroni che orbitano attorno al nucleo. Il numero atomico descrive il numero di protoni nel nucleo dell'elemento. Il numero atomico dell'idrogeno è 1, l'elio è 2, il litio è 3 e così via.
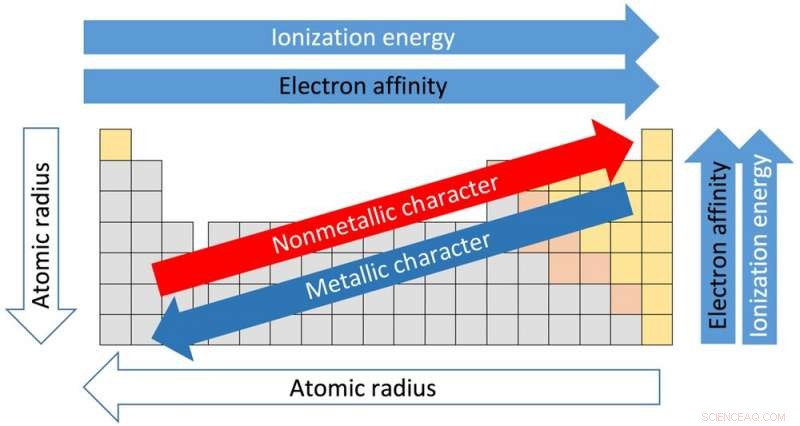
Ognuna delle 18 colonne della tabella è chiamata gruppo o famiglia. Gli elementi nello stesso gruppo condividono proprietà simili. E le proprietà possono essere assunte in base alla posizione all'interno del gruppo. Andando dalla parte superiore del gruppo I verso il basso, Per esempio, i raggi atomici – la distanza dal nucleo agli elettroni esterni – aumenta. Ma la quantità di energia necessaria per strappare un elettrone esterno diminuisce andando dall'alto verso il basso perché gli elettroni sono più lontani dal nucleo e non sono trattenuti così saldamente.
Questo è importante perché il modo in cui gli elementi interagiscono e reagiscono tra loro dipende dalla loro capacità di perdere e acquisire elettroni per creare nuovi composti.
Le righe orizzontali della tabella sono chiamate periodi. Passando dal lato sinistro del periodo a destra, il raggio atomico diventa più piccolo perché ogni elemento ha un protone in più e un elettrone in più. Più protoni significa che gli elettroni sono attratti più strettamente verso il nucleo. Per lo stesso motivo l'elettronegatività – il grado in cui un elemento tende ad acquisire elettroni – aumenta da sinistra a destra.
La forza necessaria per rimuovere l'elettrone più esterno, noto come potenziale di ionizzazione, aumenta anche dal lato sinistro del tavolo, che ha elementi dal carattere metallico, al lato destro, che sono non metalli.
L'elettronegatività diminuisce dalla parte superiore della colonna verso il basso. Anche il punto di fusione degli elementi all'interno di un gruppo diminuisce dall'alto verso il basso di un gruppo.
Applicare le basi agli elementi del Gruppo I
Come suggerisce il nome, Gli elementi del gruppo I occupano la prima colonna della tavola periodica. Ogni elemento inizia un nuovo periodo. Il litio è al vertice del gruppo ed è seguito dal sodio, N / A; potassio, K; rubidio, Rb; cesio, Cs e termina con il francio radioattivo, FR. Poiché è altamente radioattivo, praticamente nessuna chimica viene eseguita con questo elemento.
Poiché ogni elemento in questa colonna ha un singolo elettrone esterno in un nuovo guscio, i volumi di questi elementi sono grandi e aumentano vertiginosamente quando ci si sposta dall'alto verso il basso del gruppo.
Di tutti gli elementi del Gruppo I, il cesio ha i volumi più grandi perché il singolo elettrone più esterno è trattenuto in modo lasco.
Nonostante queste tendenze, le proprietà degli elementi del gruppo I sono più simili tra loro di quelle di qualsiasi altro gruppo.
I metalli alcalini attraverso la storia
Usando le proprietà chimiche come guida, Il chimico russo Dimitri Mendeleev ordinò correttamente i primi elementi del Gruppo I nella sua tavola periodica del 1869. Si chiama periodico perché ogni ottavo elemento ripete le proprietà di quello sopra di esso nella tabella. Dopo aver sistemato tutti gli elementi allora conosciuti, Mendeleev ha preso l'audace passo di lasciare spazi vuoti dove la sua estrapolazione delle proprietà chimiche ha mostrato che un elemento dovrebbe esistere. La successiva scoperta di questi nuovi elementi ha dimostrato che la sua previsione era corretta.
Alcuni metalli alcalini sono stati conosciuti e utilizzati molto prima che Mendeleev creasse la tavola periodica. Ad esempio, l'Antico Testamento cita il sale – una combinazione del metallo alcalino sodio con il cloro – 31 volte. Il Nuovo Testamento vi fa riferimento 10 volte e chiama il carbonato di sodio "neter" e il nitrato di potassio "salnitro".
La gente sapeva fin dall'antichità che le ceneri di legno producono un sale di potassio che, quando combinato con grasso animale, produrrà sapone. Samuel Hopkins ha ottenuto il primo brevetto statunitense il 31 luglio, 1790, per il sapone in base al nuovo statuto sui brevetti appena firmato in legge dal presidente George Washington pochi mesi prima.
L'industria pirotecnica ama questi elementi del Gruppo I per i loro colori vibranti e la natura esplosiva. La combustione del litio produce un vivido colore rosso cremisi; sodio uno giallo; lillà di potassio; rosso rubidio; e viola di cesio. Questi colori vengono prodotti quando gli elettroni saltano dal loro ambiente domestico orbitando attorno al nucleo e tornando indietro.
L'orologio atomico al cesio, l'orologio più preciso mai sviluppato, funziona misurando la frequenza degli elettroni di cesio che saltano avanti e indietro tra gli stati energetici. Gli orologi basati sul salto di elettroni forniscono un modo estremamente preciso per contare i secondi.
Altre applicazioni includono lampade a vapori di sodio e batterie al litio.
Nella mia ricerca ho usato i metalli del gruppo I come strumenti per eseguire altri tipi di chimica. Una volta avevo bisogno di alcol assolutamente secco, e il più secco che potevo comprare conteneva ancora minuscole tracce d'acqua. L'unico modo per sbarazzarsi dell'ultimo residuo d'acqua era trattare l'alcol contenente acqua con sodio, un modo piuttosto drammatico per rimuovere l'acqua.
Gli elementi alcalini non solo occupano la prima colonna della tavola periodica, ma mostrano anche la maggior reattività di tutti i gruppi nell'intera tabella e hanno le tendenze più drammatiche in termini di volume e potenziale di ionizzazione, pur mantenendo una grande somiglianza tra di loro.
Questo articolo è stato ripubblicato da The Conversation con una licenza Creative Commons. Leggi l'articolo originale. 