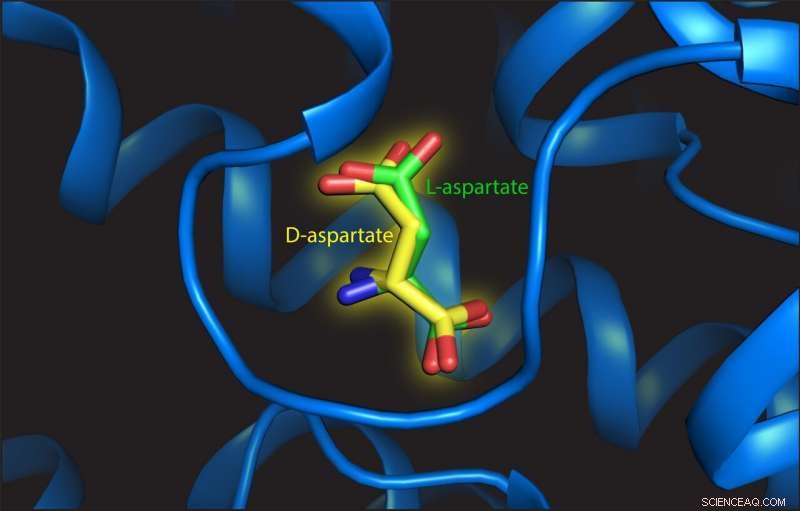
Questa illustrazione mostra L- e D-aspartato sul sito di legame della proteina di trasporto. Credito:Valentina Arkhipova, Università di Groninga
Molte biomolecole sono disponibili in due versioni che sono l'immagine speculare l'una dell'altra, come una mano sinistra e una destra. Le cellule generalmente usano la versione sinistra degli amminoacidi per produrre proteine, e si pensava che i meccanismi di assorbimento condividessero questa preferenza. Gli scienziati dell'Università di Groningen hanno ora dimostrato che una proteina di trasporto procariotica può trasportare entrambe le versioni dell'aspartato di amminoacidi con la stessa efficienza. L'analisi dettagliata della struttura del trasportatore mostra perché questo è il caso. I risultati sono stati pubblicati sulla rivista eLife il 24 aprile.
La "mano" della vita è nota da più di un secolo. Molte molecole organiche sono prodotte in due versioni che hanno la stessa formula chimica e connettività tra gli atomi ma sono strutturalmente l'immagine speculare dell'altra. Durante l'evoluzione, per alcune molecole è stata scelta la versione per mancini (L), mentre per altri viene utilizzata l'immagine speculare (D). Questo è un problema nella produzione di farmaci, dove a volte solo una versione è efficace e l'altra versione potrebbe causare gravi effetti collaterali.
Contro le aspettative
"Gli organismi viventi utilizzano L-amminoacidi nella produzione di proteine, ma useranno occasionalmente D-amminoacidi, per esempio nelle pareti cellulari batteriche, " spiega Dirk Slotboom, professore di biochimica dell'Università di Groningen. Il sistema nervoso centrale dei mammiferi ha una proteina di trasporto per il neurotrasmettitore L-glutammato che può trasportare anche l'aminoacido aspartato. "E questo risulta riconoscere sia L-aspartato che D- aspartato."
Questo va contro le aspettative. Poiché gli L-amminoacidi sono i composti funzionalmente attivi, avrebbe senso per le proteine di trasporto selezionare solo una "mano". Slotboom:"Ciò deriva dalla differenza nella struttura. Il riconoscimento da parte di un trasportatore richiede che la struttura della molecola si adatti al sito di legame". E proprio come non è possibile infilare la mano sinistra in un guanto destro, il legame dei D-amminoacidi a una proteina di trasporto che si è evoluta per accettare L-amminoacidi è impossibile.
Affinità
Finora non sono stati effettuati veri studi meccanicistici o strutturali per spiegare perché il trasportatore del sistema nervoso centrale sembra sfidare questa logica. Quindi Slotboom, insieme al collega Albert Guskov, Professore Associato e Responsabile del Laboratorio di Cristallografia a Raggi X Biomolecolari, deciso di affrontare questa domanda. La loro ricercatrice postdoc Valentina Arkhipova ha effettuato un'analisi strutturale della proteina di trasporto, mentre il dottorato lo studente Gianluca Trinco ha svolto studi funzionali. Per i loro esperimenti, hanno usato la proteina di trasporto omologa che si trova nei microrganismi, che ha un sito di legame che è quasi identico a quello del trasportatore dei mammiferi.
Trinco ha scoperto che L-aspartato e D-aspartato venivano trasportati allo stesso modo, alimentato dalla traslocazione di tre ioni sodio. "Inoltre, anche l'affinità per entrambi i substrati è simile, " dice. Arkhipova ha studiato la struttura del sito di legame con l' L- o D-aspartato attaccato. Ha osservato che il D-aspartato è stato adattato solo con piccoli riarrangiamenti della struttura:"La chiave è che c'è abbastanza spazio per l'aspartato geometricamente diverso D-aspartato da legare. Il sito di rilegatura non è come un guanto, ma più come un guanto."
Neurotrasmettitore
Nei microrganismi, la proteina trasporta solo aspartato, che le cellule potrebbero utilizzare per costruire proteine e anche utilizzare come combustibile o come fonte di azoto. Nei mammiferi, la proteina omologa trasporta il glutammato nel sistema nervoso centrale, dove l'amminoacido viene utilizzato come neurotrasmettitore. La proteina di trasporto rimuove l'L-glutammato dalla fessura sinaptica, la parte in cui un impulso nervoso viene trasmesso a un altro neurone.
Ci sono indicazioni che l'aspartato possa agire anche come neurotrasmettitore. "Se così fosse, sia L- che D-aspartato potrebbero svolgere questa funzione, " dice Slotboom. "L'affinità per entrambi i tipi di aspartato è molto alta. Questo potrebbe indicare una funzione specifica e suggerisce che anche il D-aspartato è usato per qualcosa." È interessante notare che Il D-glutammato non è accettato dal trasportatore. Ancora, questa sembra essere una questione di spazio:il glutammato ha un gruppo metilenico in più rispetto all'aspartato. "E nel D-glutammato, che il metilene probabilmente provoca uno scontro con il sito di legame." Non si adatta, nemmeno in un guanto.