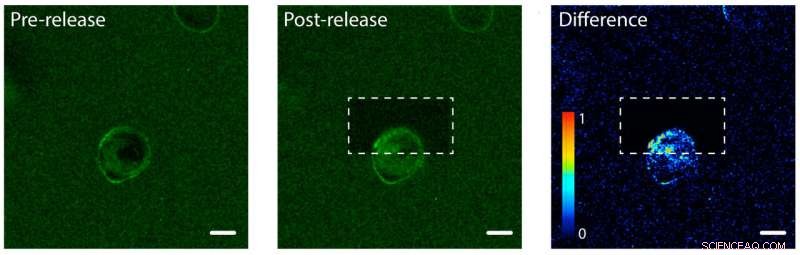
Fotorilascio delle proteine del fattore di crescita epidermico (EGF) su un lato di una cellula umana. A sinistra:l'EGF (verde) è legato a un idrogel di una singola cellula umana (al centro). La membrana cellulare lega l'EGF, rendendo la sua membrana verde. Centro:l'idrogel dopo aver usato un laser per slegare e rilasciare le proteine EGF sulla parte superiore della cellula. A destra:un'immagine che mostra la differenza di colore verde fluorescente tra le immagini post-rilascio e pre-rilascio. Notare l'aumento di colore nella parte superiore della cella, il che indica che la cellula ha iniziato a interiorizzare le proteine EGF non legate ma solo su un lato. La barra della scala è di 10 micrometri. Attestazione:Shadish, Benuska e DeForest, 2019, Materiali della natura
L'ingegneria dei tessuti potrebbe trasformare la medicina. Invece di aspettare che i nostri corpi ricrescano o riparino i danni dopo un infortunio o una malattia, gli scienziati potrebbero diventare complessi, tessuti completamente funzionali in un laboratorio per il trapianto in pazienti.
Le proteine sono la chiave di questo futuro. Nei nostri corpi, i segnali proteici dicono alle cellule dove andare, quando dividere e cosa fare. Nel laboratorio, gli scienziati usano le proteine per lo stesso scopo:posizionare le proteine in punti specifici su o all'interno di scaffold ingegnerizzati, e quindi utilizzando questi segnali proteici per controllare la migrazione cellulare, divisione e differenziazione.
Ma anche le proteine in questi contesti sono fragili. Per farli aderire alle impalcature, i ricercatori hanno tradizionalmente modificato le proteine usando sostanze chimiche che uccidono oltre il 90% della loro funzione. In un articolo pubblicato il 20 maggio sulla rivista Materiali della natura , un team di ricercatori dell'Università di Washington ha svelato una nuova strategia per mantenere le proteine intatte e funzionali modificandole in un punto specifico in modo che possano essere legate chimicamente allo scaffold usando la luce. Poiché il cavo può essere tagliato anche con luce laser, questo metodo può creare modelli in evoluzione di proteine segnale attraverso un'impalcatura di biomateriali per far crescere tessuti costituiti da diversi tipi di cellule.
"Le proteine sono gli ultimi comunicatori di informazioni biologiche, " ha detto l'autore corrispondente Cole DeForest, un assistente professore UW di ingegneria chimica e bioingegneria, così come un investigatore affiliato con l'UW Institute for Stem Cell &Regenerative Medicine. "Guidano praticamente tutti i cambiamenti nella funzione cellulare:differenziazione, movimento, crescita, Morte."
Per tale motivo, gli scienziati hanno impiegato a lungo le proteine per controllare la crescita e la differenziazione cellulare nell'ingegneria dei tessuti.
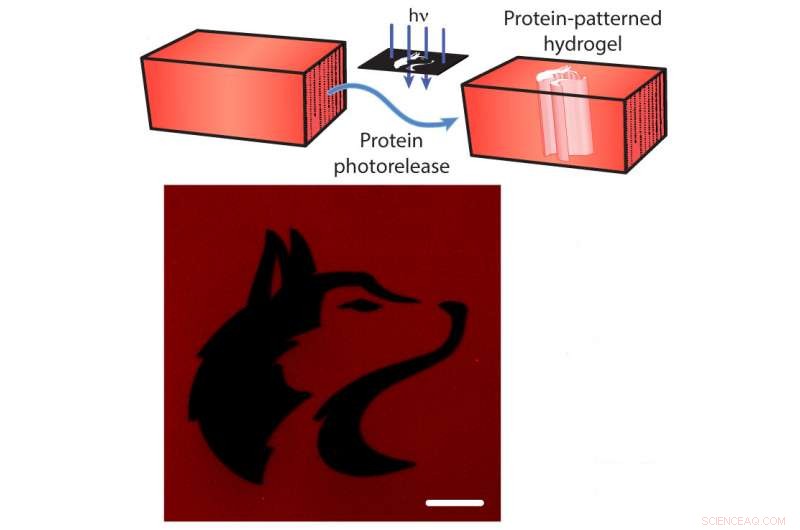
Fotorilascio di proteine da un idrogel. In alto:le proteine fluorescenti rosse mCherry sono legate all'idrogel. I ricercatori possono fendere il cavo con la luce diretta (frecce blu), rilasciando il mCherry dall'idrogel (frecce blu). In basso:un'immagine dell'idrogel dopo il rilascio di mCherry modellato nella forma della mascotte dell'Università di Washington (nera). La barra della scala è di 100 micrometri. Attestazione:Shadish, Benuska e DeForest, 2019, Materiali della natura.
"Ma le sostanze chimiche più comunemente usate dalla comunità per legare le proteine ai materiali, compresi scaffold per l'ingegneria dei tessuti, distruggere la stragrande maggioranza della loro funzione, " ha detto DeForest, che è anche membro di facoltà presso l'UW Molecular &Engineering Sciences Institute. "Storicamente, i ricercatori hanno cercato di compensare questo semplicemente sovraccaricando l'impalcatura con proteine, sapendo che la maggior parte di loro sarà inattiva. Qui, abbiamo trovato un modo generalizzabile per funzionalizzare i biomateriali in modo reversibile con le proteine preservando la loro piena attività".
Il loro approccio utilizza un enzima chiamato sortase, che si trova in molti batteri, per aggiungere un breve peptide sintetico a ciascuna proteina segnale in una posizione specifica:il C-terminale, un sito presente su ogni proteina. Il team progetta quel peptide in modo tale da legare la proteina segnale a posizioni specifiche all'interno di un'impalcatura di biomateriali piena di liquido comune nell'ingegneria dei tessuti, noto come idrogel.
Il targeting di un singolo sito sulla proteina segnale è ciò che distingue l'approccio del team UW. Altri metodi modificano le proteine segnale attaccando gruppi chimici in posizioni casuali, che spesso interrompe la funzione della proteina. Modificando solo il C-terminale della proteina è molto meno probabile che si interrompa la sua funzione, secondo DeForest. Il team ha testato l'approccio su più di mezza dozzina di diversi tipi di proteine. I risultati mostrano che la modifica del C-terminale non ha effetti significativi sulla funzione delle proteine, e lega con successo le proteine in tutto l'idrogel.
Il loro approccio è analogo ad appendere un'opera d'arte incorniciata su un muro. Invece di piantare chiodi a caso attraverso il vetro, tela e cornice, mettono un singolo filo sul retro di ogni cornice per appenderlo al muro.
Inoltre, i cavi possono essere tagliati dall'esposizione alla luce laser focalizzata, provocando il "fotorelease" delle proteine. L'uso di questa spada laser scientifica consente ai ricercatori di caricare un idrogel con molti diversi tipi di segnali proteici, e quindi esporre l'idrogel alla luce laser per separare le proteine da alcune sezioni dell'idrogel. Esponendo selettivamente solo porzioni dei materiali alla luce laser, il team ha controllato dove i segnali proteici sarebbero rimasti legati all'idrogel.

Da sinistra a destra:Cole DeForest, Gabrielle Benuska, Jared Shadish. Credito:Dennis Wise/Università di Washington
La separazione delle proteine è utile negli idrogel perché le cellule potrebbero quindi assorbire quei segnali, portandoli all'interno della cellula dove possono influenzare processi come l'espressione genica.
Il team di DeForest ha testato il processo di fotorilascio utilizzando un idrogel caricato con fattore di crescita epidermico, un tipo di segnale proteico. Hanno introdotto una linea cellulare umana nell'idrogel e hanno osservato i fattori di crescita che si legano alle membrane cellulari. Il team ha utilizzato un raggio di luce laser per svincolare i segnali proteici su un lato di una singola cellula, ma non dall'altra parte. Sul lato legato della cella, le proteine sono rimaste all'esterno della cellula poiché erano ancora attaccate all'idrogel. Sul lato non legato, i segnali proteici sono stati internalizzati dalla cellula.
"In base a come puntiamo la luce laser, possiamo garantire che cellule diverse, o anche parti diverse di singole cellule, ricevano segnali ambientali diversi, " ha detto DeForest.
Questo livello unico di precisione all'interno di una singola cellula non solo aiuta con l'ingegneria dei tessuti, ma con la ricerca di base in biologia cellulare, aggiunto DeForest. I ricercatori potrebbero utilizzare questa piattaforma per studiare come le cellule viventi rispondono a molteplici combinazioni di segnali proteici, Per esempio. Questa linea di ricerca aiuterebbe gli scienziati a capire come i segnali proteici lavorano insieme per controllare la differenziazione cellulare, guarire i tessuti malati e promuovere lo sviluppo umano.
"Questa piattaforma ci consente di controllare con precisione quando e dove i segnali delle proteine bioattive vengono presentati alle cellule all'interno dei materiali, " ha detto DeForest. "Questo apre le porte a molte interessanti applicazioni nell'ingegneria dei tessuti e nella ricerca terapeutica".