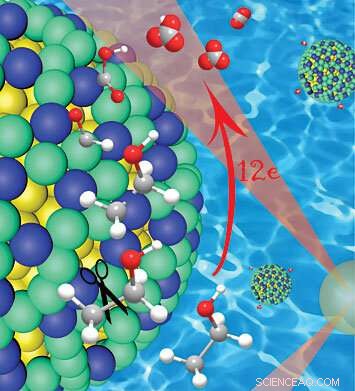
Un primo piano del guscio di platino/iridio (verde/blu) su un nucleo di nanoparticelle d'oro (giallo), mostrando come questo catalizzatore scinde i legami carbonio-carbonio (grigio) in etanolo lasciando inizialmente gli atomi di idrogeno attaccati. L'idrogeno protegge il carbonio nelle prime fasi della reazione, prevenire la formazione di monossido di carbonio avvelenato dal catalizzatore, che consente la completa ossidazione e il rilascio di 12 elettroni. Credito:Brookhaven National Laboratory
Gli scienziati del Brookhaven National Laboratory del Dipartimento dell'Energia degli Stati Uniti (DOE) e dell'Università dell'Arkansas hanno sviluppato un catalizzatore altamente efficiente per estrarre energia elettrica dall'etanolo, un combustibile liquido facile da immagazzinare che può essere generato da risorse rinnovabili. Il catalizzatore, descritto nel Giornale della Società Chimica Americana , dirige l'elettro-ossidazione dell'etanolo lungo un percorso chimico ideale che libera l'intero potenziale di energia immagazzinata del combustibile liquido.
"Questo catalizzatore è un punto di svolta che consentirà l'uso di celle a combustibile a etanolo come fonte promettente ad alta densità di energia elettrica 'off-the-grid', " ha detto Jia Wang, il chimico del Brookhaven Lab che ha guidato il lavoro. Un'applicazione particolarmente promettente:i droni alimentati a celle a combustibile liquido.
"Le celle a combustibile a etanolo sono leggere rispetto alle batterie. Fornirebbero energia sufficiente per far funzionare i droni utilizzando un carburante liquido facile da ricaricare tra un volo e l'altro, anche in località remote, " ha osservato Wang.
Gran parte del potenziale potere dell'etanolo è racchiuso nei legami carbonio-carbonio che formano la spina dorsale della molecola. Il catalizzatore sviluppato dal gruppo di Wang rivela che rompere quei legami al momento giusto è la chiave per sbloccare quell'energia immagazzinata.
"L'elettroossidazione dell'etanolo può produrre 12 elettroni per molecola, "Ha detto Wang. "Ma la reazione può progredire seguendo molti percorsi diversi".
La maggior parte di questi percorsi provoca un'ossidazione incompleta:i catalizzatori lasciano intatti i legami carbonio-carbonio, rilasciando meno elettroni. Inoltre eliminano gli atomi di idrogeno all'inizio del processo, esponendo gli atomi di carbonio alla formazione di monossido di carbonio, che "avvelena" la capacità dei catalizzatori di funzionare nel tempo.

Membri del Brookhaven Lab del team di ricerca che ha sviluppato e caratterizzato un nuovo catalizzatore core-shell per l'elettroossidazione completa dell'etanolo (da sinistra a destra):Radoslav Adzic, Zhixiu Liang, Jia Wang, Eli Stavitski, e Liang Song. Credito:Brookhaven National Laboratory
"L'ossidazione completa a 12 elettroni dell'etanolo richiede la rottura del legame carbonio-carbonio all'inizio del processo, mentre gli atomi di idrogeno sono ancora attaccati, perché l'idrogeno protegge il carbonio e previene la formazione di monossido di carbonio, " disse Wang. Poi, sono necessarie più fasi di deidrogenazione e ossidazione per completare il processo.
Il nuovo catalizzatore, che combina elementi reattivi in un'esclusiva struttura nucleo-guscio che gli scienziati di Brookhaven hanno esplorato per una serie di reazioni catalitiche, accelera tutti questi passaggi.
Per fare il catalizzatore, Jingyi Chen dell'Università dell'Arkansas, che era uno scienziato in visita a Brookhaven durante parte di questo progetto, ha sviluppato un metodo di sintesi per co-depositare platino e iridio su nanoparticelle d'oro. Il platino e l'iridio formano "isole monoatomiche" sulla superficie delle nanoparticelle d'oro. quella disposizione, Chen ha notato, è la chiave che spiega le eccezionali prestazioni del catalizzatore.
"I nuclei di nanoparticelle d'oro inducono sforzi di trazione nelle isole monoatomiche di platino-iridio, che aumenta la capacità di quegli elementi di scindere i legami carbonio-carbonio, e poi strappa via i suoi atomi di idrogeno, " lei disse.
Zhixiu Liang, uno studente laureato alla Stony Brook University e il primo autore dell'articolo, ha eseguito studi nel laboratorio di Wang per capire come il catalizzatore raggiunge la sua efficienza di conversione energetica record. Ha usato "spettroscopia di riflessione-assorbimento infrarosso in situ" per identificare gli intermedi e i prodotti di reazione, confrontando quelli prodotti dal nuovo catalizzatore con reazioni che utilizzano un catalizzatore con nucleo d'oro / guscio di platino e anche un catalizzatore in lega di platino-iridio.

Uno schema che mostra come le "isole monoatomiche" di platino (verde) e iridio (blu) sulla superficie delle nanoparticelle d'oro (giallo) consentono un'ossidazione completa a 12 elettroni dell'etanolo senza avvelenamento da monossido di carbonio. Il grafico illustra la corrente di picco notevolmente più elevata prodotta dal nuovo catalizzatore (Au@PtIr) rispetto ad altri tre catalizzatori:nucleo d'oro/guscio di iridio (Au@Ir); lega iridio/platino (IrPt); e guscio in oro/platino (Au@Pt). Credito:Brookhaven National Laboratory
"Misurando gli spettri prodotti quando la luce infrarossa viene assorbita in diverse fasi della reazione, questo metodo ci permette di tracciare, ad ogni passo, quali specie si sono formate e quanto di ciascun prodotto, " Ha detto Liang. "Gli spettri hanno rivelato che il nuovo catalizzatore dirige l'etanolo verso il percorso di ossidazione completa a 12 elettroni, liberando il pieno potenziale del carburante di energia immagazzinata."
Il prossimo passo, Wang ha notato, è progettare dispositivi che incorporino il nuovo catalizzatore.
I dettagli meccanicistici rivelati da questo studio possono anche aiutare a guidare la progettazione razionale di futuri catalizzatori multicomponenti per altre applicazioni.